Ejemplo 16
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Nomenclatura y simbología orgánica IV (continuación)
Reglas de la IUPAC I (HIDROCARBUROS)
Entre los años 60 y 70, la
IUPAC. cambió de nombre, intitulándose “Comisión en la nomenclatura de Química Orgánica”,
con siglas CNOC, publicándose nuevas
secciones. La C tendría especial relevancia, ya que abarcaba los compuestos
con oxígeno y nitrógeno en las diferentes familias: ácidos y derivados, amidas
y nitrilos, aldehidos, cetonas, alcoholes y éteres, aminas, estableciéndose
un orden de prelación de funciones, importantísimo a la hora de la elección
de la cadena principal. Este orden de prelación que aparece en la tabla 10,
de las reglas IUPAC, y del cual se han extraido los compuestos menos frecuentes es el siguiente:
Radicales> Aniones> Cationes>Ácidos>Ánhídridos>Ésteres>Haluros deácido>Amidas>Imidas>Nitrilos>
Aldehidos>Cetonas>Alcoholes
y fenoles>Aminas>Iminas>Éteres>Alquenos>Alquinos>Alcanos.
Sin
embargo la nomenclatura orgánica cada vez se complicaba
mas, haciéndose necesarias nuevas normas
de numeración de cadenas, que provocaron en 1971, la introducción de los paréntesis y corchetes
para radicales cada vez más complejos. Los radicales expresados en las tablas
1 y 2 de Nomenclatura y simbología orgánica III, aunque están permitidos,
también pueden nombrarse sistemáticamente como radicales complejos, disponiéndose
entre paréntesis, así:
| Radical (A-2.2.5) |
Radical sistemático |
| Isopropil |
(1-metiletil) |
| Tert-butil |
(1,1-dimetiletil) |
| Sec-butil |
(1-metilpropil) |
| Isopentil |
(3-metilbutil) |
| Tert-pentil |
(1,1-dimetilpropil) |
| Neopentil |
(2,2-dimetilpropil) |
La guerra química en la nomenclatura orgánica está servida, y los sistemas Beilstein (La biblia orgánica mundial, en alemán , donde se registran todos los compuestos aislados con sus características, creada por Beilstein en 1885) y Chemical Abstract (Sociedad Química Norteamericana) , eran muy dispares [148] . Los problemas son múltiples, y la IUPAC no tiene más remedio que en 1979, poner de acuerdo a ambas corrientes, y crear una nueva reunificación de las reglas de la nomenclatura en química orgánica que publica en el llamado libro azul (por sus capas). En este libro se establecen las reglas que se deberán seguir para unificar las nomenclatura de los compuestos orgánicos. Pero hay un hecho fundamental aparte de fijar entre paréntesis los radicales complejos, y es que el localizador siempre estará delante de lo que debe localizar, separándose con guiones. Las ramificaciones iguales deberán reunirse, con localizadores seguidos que se separarán por comas. La última ramificación salvo que sea compleja deberá unirse nominalmente a la cadena principal.
En los hidrocarburos (serie
A), se establecen normas de numeración
y elección de cadena principal.
Regla A-2.1.
Los hidrocarburos alicíclicos ramificados, se nombran, precedidos del nombre
de las cadenas laterales, presentes en la cadena más larga.
Regla A-2.2.
La cadena mas larga se numera de principio a fin con números arábigos, eligiendo
la dirección, de forma que las cadenas laterales presenten los números más
bajos posible. Si tuvieran el mismo número, se compararía término a término
hasta encontrar la posición mas baja, independientemente de la naturaleza
de los sustituyentes.
Véase el ejemplo 16

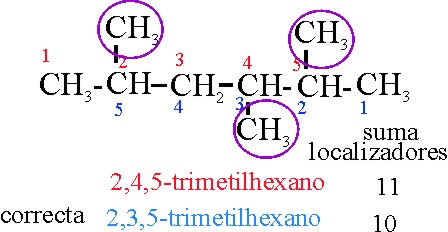
Ejemplo 16
Reglas aplicadas:
A-2.1. Cadena más larga: sucesión de carbonos
lo mayor posible
A-2.2
Si se comienza por la derecha
, los localizadores son: 2, 3 y 5 cuya suma es 10. Si por la izquierda
son: 2, 4 y 5, cuya suma es 11. Por lo tanto se debe comenzar por la derecha.
Regla A-2.3
Si
dos o mas cadenas laterales tienen diferente naturaleza, deberán citarse en
orden alfabético, como sigue.
Véase el ejemplo 17.
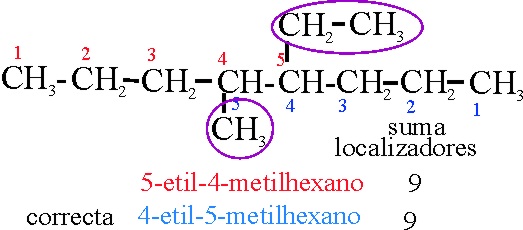
Ejemplo 17
Reglas
aplicadas:
A-2.1
A-2.2
Si se comienza por la derecha
, los localizadores son: 4 y5 cuya
suma es 9. Si por la izquierda, también suman 9.
A-2.3
Predomina la clasificación alfabética, y
la e está antes que la m, porlo tanto al etil debe ir el número mas bajo , por lo que se numera por la derecha.
Las ramificaciones se nombrarán
alfabéticamente, prescindiendo de los prefijos numéricos que puedan
modificarlos, así un metil, estará en un nombre delante de un dipropil, pero
detrás de un isopropil y de su numeración por localizadores. Todo ello está
expresado en las siguientes reglas:
Regla A-2.3i
Los
nombres de los radicales simples, primero se alfabetizan y se insertan con
los prefijos multiplicativos necesarios ( di, tri,
etc).
Regla
A-2.3ii
El nombre de un radical
complejo, se considera por la primera letra de su nombre completo.
Regla
A-2.3iii
En el caso de nombre de
radicales complejos formados por paralabras idénticas, tendrá prioridad en
la citación el radical que contiene el localizador mas bajo.
Veamos el ejemplo 18
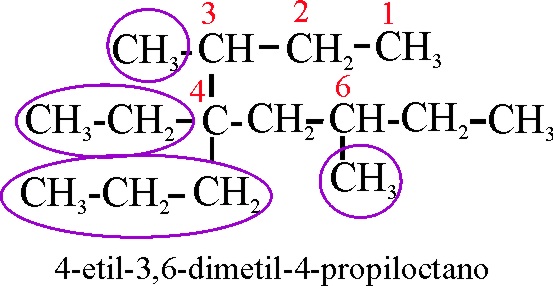
Ejemplo 18
Reglas aplicadas:
A-2-2.
Referencia al comienzo de la numeración de la cadena principal.
A-2-3-i.
Referencia a la disposición alfabética de los radicales.
Regla A-2.4.
Si
hay dos o mas cadenas laterales que tienen posiciones
equivalentes, la primera en asignarse es la citada en primer lugar según su
nombre
Veamos el ejemplo 19
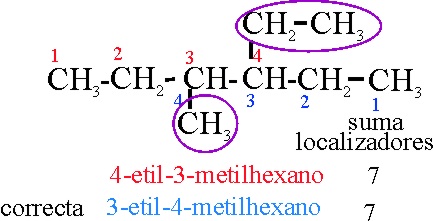
Ejemplo 19
Reglas aplicadas:
A-2-2.
Referencia al comienzo de la numeración de la cadena principal.
A-2-3-i.
Referencia a la disposición alfabética de los radicales.
A-2-4
Referencia
al cambio de orden según letra inicial
Sin embargo si existen
radicales complejos, no se seguirán los principios anteriores, sino que contará
la primera letra, como se ha dicho en la regla A-2.3iii
Así en el ejemplo 15, etil
estaba antes que dimetil y éste que propil.
Si los radicales fueran,
(1,1-dimetiletil), etil y metil, el orden sería éste, o sea que contaría la
d antes que la e, como vemos en el ejemplo 20.
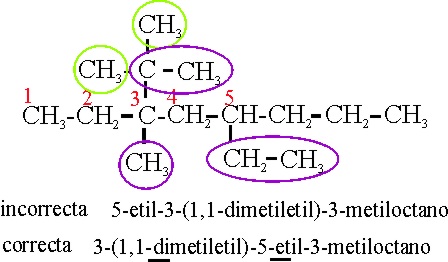
Ejemplo 20
Reglas aplicadas:
A-2-2. Referencia al comienzo de la numeración de la cadena principal.
A-2-3-ii. Referencia a la disposición alfabética de los radicales, cuando son complejos.
Cuando existen radicales
complejos repetidos, se nombra con unos prefijos multiplicativos de grupos,
tal como los que se emplearán en la nomenclatura inorgánica (bis=2; tris=3;
tetrakis=4 , pentakis=5, etc).(Regla A.2.5
[149]
)
También se pueden expresar
con numeros primados, en este caso no harían falta paréntesis, y el nombre
anterior sería: 3,5-bis-1’-metiletiloctano. En el ejemplo 21:
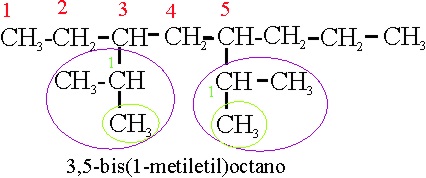
Ejemplo 21
Reglas aplicadas
A-2-2. Referencia al comienzo de la numeración de la cadena principal
A-2-5(b)- Referencia a multiplcativos de radicales complejos
Cuando existen varias posibilidades
de cadena principal, la regla A-2-6, determina la elección:
Regla A-2.6
Si
existen varias cadenas de igual longitud, la selección de la cadena principal
se hará de la manera siguiente:
a)
La que tenga mayor número de cadenas laterales
b)
La que tenga cadenas laterales con localizadores mas
bajos
c)
La cadena con mayor número de carbonos en las cadenas laterales más pequeñas
d)
La cadena con cadenas laterales lo menos ramificadas
Por qué el ejemplo 18 no se podría formular tal como el 18-2
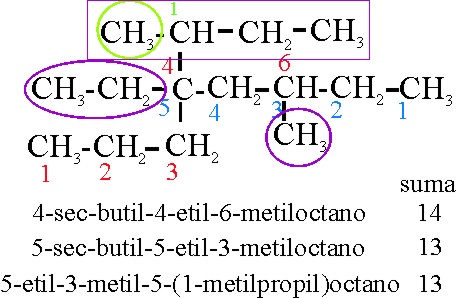
Ejemplo 18-2
Reglas aplicadas
A-2-2. Referencia al comienzo de la numeración de la cadena principal
A-2-3-ii. Referencia a la disposición alfabética de los radicales, cuando son complejos. Pese a no ser un prefijo numérico, como está separado por guión, se considera como adjunto al nombre y la s del sec no se considera frente a la b, de butil, que irá delante.
A-2-6(a)- Referencia al número de cadenas laterales máximo. En este caso, de la suma 13 de localizadores, provocaría 3 cadenas laterales, sobre una cadena principal de 8 carbonos. En el ejemplo 18, eran 4 las cadenas laterales
El problema surgirá con
el orden de alfabetización de las ramificaciones,
dado que estas se pueden nombrar como radicales complejos con paréntesis,
con números primados, o simplemente como formas isoméricas. Así en el caso
anterior, sumando 13 los localizadores, se tienen dos nombres con el ordenamiento
de las cadenas laterales. En los primeros casos el sec-butil irá delante,
mientras que en el último irá detrás, al disponerlo como radical complejo,
por lo tanto se tienen dos nombres permitidos para el mismo compuesto.
Aplicación de las reglas
anteriores
Veamos el ejemplo 22, en
dos versiones. 22 A, y 22 B, correspondiente al mismo compuesto.
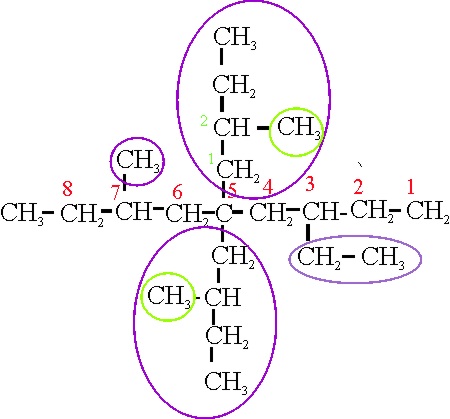
Ejemplo 22A
Ejemplo 22B
En el caso A, la cadena principal se orienta
verticalmente. Las ramificaciones salen de localizadores simétricos, de forma
que puede comenzar la numeración desde cualquiera de las dos posiciones. Hay
4 ramificaciones, 2 pequeñas y 2 complejas. Su nombre sería:
22 A: 3,7-dimetil-5-(2-etilbutil)-5-(2-metilbutil)-nonano
En el caso B, la cadena principal se orienta
horizontalmente. Las ramificaciones salen de localizadores simétricos, de
forma que puede comenzar la numeración desde cualquiera de las dos posiciones.
Hay 4 ramificaciones, 2 pequeñas y 2 complejas. Su nombre sería con alfabetización
según regla A-2.3ii y A-2.5b:
22 B: 3-etil-7-metil- 5,5-bis(2-metilbutil)-nonano
En ambos casos hay:
9 carbonos en la cadena principal= nonano
4 cadenas laterales: empate al aplicar la
regla A-2.6a
Suma de localizadores: 22 A (20); 22 B (20):
empate al aplicar la regla A-2.6b
En la 22 A, las cadenas laterales pequeñas
tiene 1 C, en la 22 B, estas cadenas tienen 1 y 2C, por aplicación de la regla
A-2.6c, se eligen el modelo 22 B, como nombre del compuesto.
Nombre del compuesto: 3-etil-7-metil- 5,5-bis(2-metilbutil)-nonano
Simplemente con cambiar
la posición del metilo(3), en el ejemplo 22 D, la
cadena principal ya sería la del 22 A.
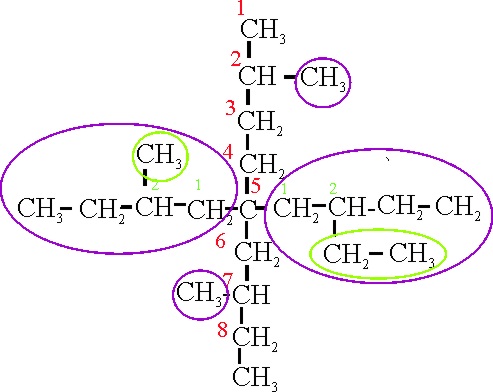
Ejemplo 22D
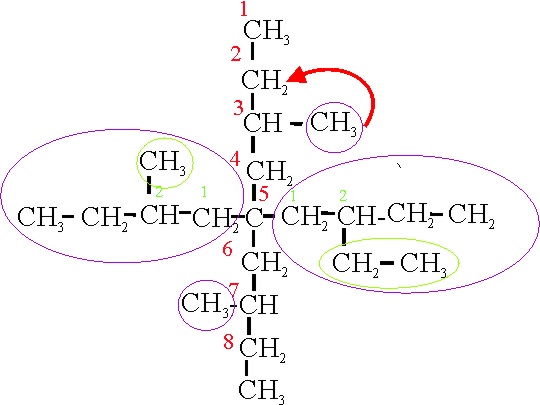
Ejemplo 22C
Por aplicación de A-2.6b
y su nombre será:
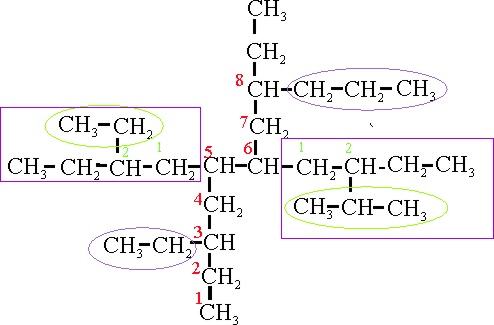
Ejemplo 23A
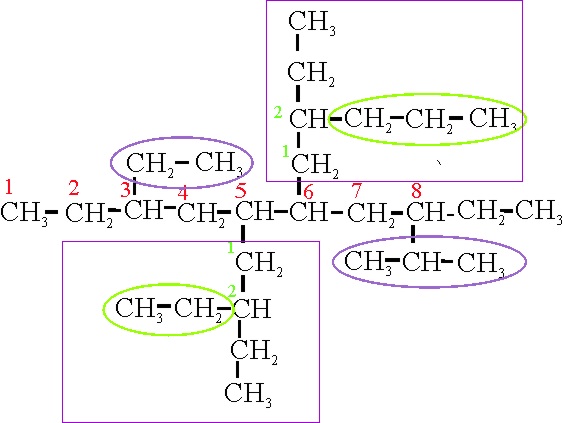
Ejemplo 23B
En el caso 23A, la cadena principal se orienta
verticalmente. Las ramificaciones salen de localizadores simétricos (3,5,6 y 8), de forma que puede comenzar la numeración desde
cualquiera de las dos posiciones. Hay 4 ramificaciones, 2 pequeñas y 2 complejas.
Su nombre con alfabetización según reglas A-2.3ii y A-2.5b sería:
23 A: 3-etil-5-(2-etilbutil)-6-(2-isopropilbutil)-8-propildecano
En el caso 23B, la cadena principal se orienta
horizontalmente. Las ramificaciones salen de localizadores simétricos, 3,5,6
y 8, de forma que puede comenzar la numeración desde cualquiera de las dos
posiciones. Hay 4 ramificaciones, 2 pequeñas y 2 complejas. Su nombre sería
con alfabetización según reglas A-2.3ii y A-2.5b:
23 B: 3-etil-5-(2-etilbutil)- 8-isopropil-6-(2-propilbutil)-decano
En ambos casos hay:
9 carbonos en la cadena principal= nonano
4 cadenas laterales: empate al aplicar la
regla A-2.6a
Suma de localizadores: 23 A (23); 23 B (23):
empate al aplicar la regla A-2.6b
En ambos casos, las cadenas laterales pequeñas
tiene 2 y 3 C: empate al aplicar la regla A-2.6c.
La
aplicación de la regla A-2.6d, se elige el modelo B, prefiriendo el propil
al isopropil mas ramificado como nombre del compuesto.
Su nombre será por lo tanto:
3-etil-5-(2-etilbutil)- 8-isopropil-6-(2-propilbutil)-decano
Las reglas A-3, hacen referencia
a los hidrocarburos insaturados
A-3.1
“Los
hidrocarburos acíclicos insaturados no ramificados, con un doble enlace, se
nombran sustituyendo el sufijo ano, correspondiente al saturado por eno. Si
hubiera mas de un doble enlace, lo haría por “adieno”,
“atrieno” etc. Los nombres genéricos de estos hidrocarburos(ramificados
o no ramificados), son “alqueno”, “alcadieno”, alcatrieno” etc. La cadena
se numerará, de forma que los dobles enlaces tengan los números más bajos.
En compuestos cíclicos o en sus derivados, si los localizadores de un doble
enlace difieren en una unidad, sólo se citará el inferior en el nombre. Si
difieren en mas, se citarán entre paréntesis, uno detrás del otro”.
A-3.2
“Los
hidrocarburos acíclicos insaturados no ramificados, con un triple enlace,
se nombran sustituyendo el sufijo ano, correspondiente al saturado por ino.
Si hubiera mas de un triple enlace, lo haría por
“adiino”, “atriino” etc. Los nombres genéricos de estos hidrocarburos(ramificados
o no ramificados), son “alquino”, “alcadiino”, alcatriino” etc. La cadena
se numerará, de forma que los triples enlaces tengan los números más bajos.
Solo se citará el localizador más bajo para el triple enlace, en el nombre
del compuesto”.
A-3.3
“Los
hidrocarburos acíclicos insaturados no ramificados, con dobles y triples enlaces, se nombran sustituyendo el sufijo
ano, correspondiente al saturado por “enino”,”adienino”, “atrienino”, “enodiino”
etc. La cadena se numerará, de forma que los dobles y triples enlaces tengan los números más bajos,
aunque esto produzca un localizador de un ino inferior a un eno. Cuando se
pueda elegir entre ambos, siempre el eno tendrá el número más bajo”.
A-3.4
“Los
hidrocarburos acíclicos insaturados ramificados, con dobles y triples enlaces, se nombran como los no ramificados, de forma que contenga el
mayor número de dobles y triples. Si hubiera dos o mas cadenas compitiendo
por una elección:
1º.
La que tenga mayor número de carbonos
2º.La
que contenga el mayor número de dobles enlaces.
En
todo caso se aplicarán los mismos principios que en los hidrocarburos saturados
ramificados.La cadena será numerada de forma que a los dobles y triples enlaces
le corresponda la numeración más baja, de acuerdo con la regla A-3.3
Así
los ejemplos dados en la primera parte, correspondientes a la nomenclatura
de Ginebra se denominarían así por aplicación de
estas reglas
| |
Ginebra |
Reglas 1979 |
| Ejemplo 2 |
metil-2-penteno 3 |
4-metil-2-penteno |
| Ejemplo 3 |
penteno 3- ino 1 |
3-penten-1-ino |
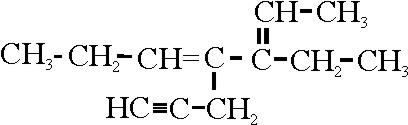
Ejemplo 24
Reglas aplicadas
A-3-3. Referencia a la elección de la cadena principal
Situación de empate en la A-3.3.1 y A-3.3.2
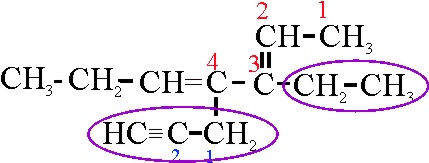
Ejemplo 24A
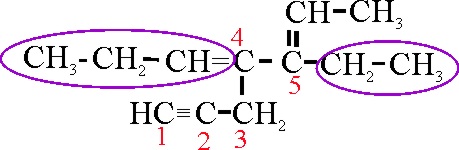
Ejemplo 24B
Dado que se da preferencia
a los dobles enlaces sobre los triples, se elige como cadena principal la
24 A.
El tercer paso es la numeración,
que debe ser mínima para los dobles y triples enlaces. La numeración que se
da en la 24 A, proporciona unos localizadores 2,
y 4 para dobles enlaces. Si comenzase por la posición opuesta, sería 3 y 5.
Por lo tanto su nombre será: 3-etil-4-(2-propinil)-2,4-heptadieno.
Las normas A-3.5 y A-3.6,
se dedican a estudiar los radicales insaturados, y no modifican las norma-tivas
anteriores ya explicadas.
Las normas A-4, se dedican
a radicales polivalentes.
La A-11, a ciclos y radicales
de ciclos. Se deberá tener en cuenta que en este caso la posición del radical,
será numerada con el 1.
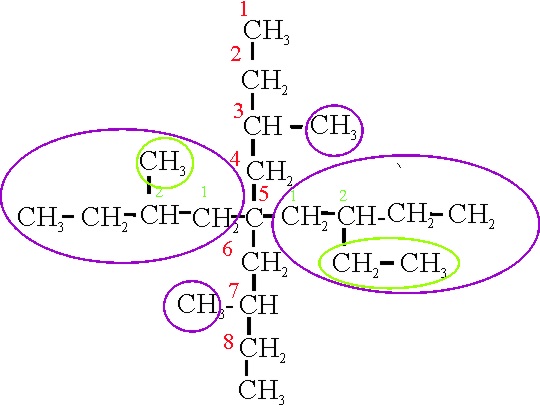
Veamos el ejemplo 25
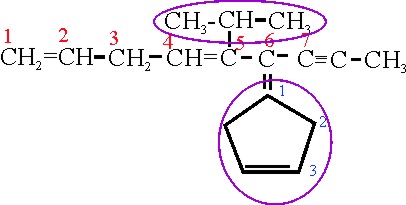
Ejemplo 25
Reglas aplicadas
A3.4.
Si se comienza a numerar la cadena principal por la derecha , el triple enlace estará sobre el C2, y los dobles estarían en C5 y C8, sumando 15, mientras tal como está numerada, suman 12. Así sobre el C5, habrá un isopropil(metiletil) y sobre el C6, con una unión doble, un ciclopentenil que por ese motivo se denominará ciclopentenilideno.
A11
Numera el doble enlace del radical,
a partir de la inserción de la ramificación, en la posición
3, será por lo tanto 3-ciclopentenilideno
Las reglas A-12 y A13,
hacen referencia a los núcleos aromáticos y derivados. De aquí en adelante,
se presentan compuestos no usuales en las enseñanzas medias: A-20…. Policiclos;
A-30… hidrocarburos con puente; A-40.. hidrocarburos espiránicos; A-50… asociación de anillos.
En el bloque A-12. Las A-12.1 y A-12.2 hacen referencia a los derivados del benceno
con nombres triviales.
La A-12.3, es importante
y dice así: “La posición de los sustituyentes
será indicada por números excepto que se usen los términos o-(“orto”), m-
(“meta”) y p-(“para”), para las posiciones 1,2; 1,3 y 1,4 respectivamente,
sólo para el caso de que existan dos. Los sustituyentes tendrán los
números mas bajos posibles, y se regularán por la regla A-2, excepto para
aquellos compuestos que partan de nombres triviales, cuyos sustituyentes tendrán
prioridad al ser numerados”.
Veamos los ejemplo 26 y 27
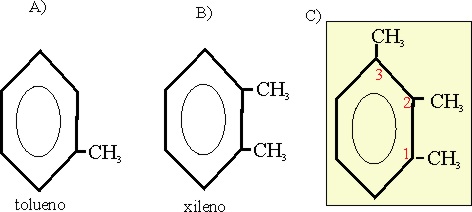
Ejemplo 26
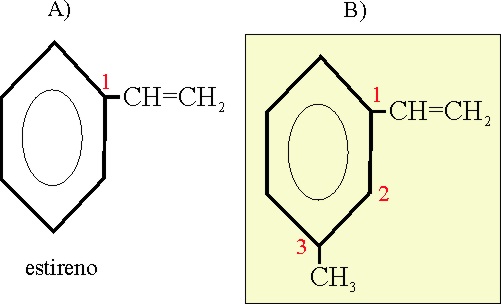
Ejemplo 27
Reglas aplicadas
A-12-3. la nomenclatura orto, meta y para, sólo se puede aplicar cuando hay dos sustituyentes.
Se puede nombrar 1,2,3-trimetilbenceno
No :o-metil-xileno ni dimetil-tolueno
Reglas aplicadas
A-12-3. Comola nomenclatura orto, meta y
para se puede aplicar cuando hay dos
sustituyentes.
Se
puede nombrar dando la posición 1 al sustituyente de su nombre trivial.
Meta-metilestireno
o 3-metilestireno o
1-metil-3-vinil-benceno (empleando las dos ramificaciones, y por aplicación de la A-2.2, para la alfabetización, ya que no se parte del nombre trivial.
Se quiere formular el compuesto
en recuadro
Y se puede partir de sus derivados con nombres triviales
expuestos delante
[148]
El sistema Beilstein, alemán era muy diferente del norteamericano Chemical Abstract.
[149]
La regla A-2.5, dice textualmente: “La presencia de radicales idénticos en la misma cadena, se indican con
prefijos multiplicativos: bis, tris, tetrakis, pentakis etc. La expresión
completa de la cadena lateral puede encerrarse entre paréntesis, o los
átomos de los carbonos de las cadenas laterales pueden indicarse con números
primados”.