GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
LA GUERRA DE LOS
SÍMBOLOS Y DE LOS NOMBRES
El último elemento descubierto empleando
las técnicas normales de trasmutación nuclear, o sea el bombardeo con neutrones o con partículas
alfa muy aceleradas de núclidos de gran masa atómica, fue el MENDELEVIUM (Z=101). La primacía de su síntesis estaba
en la universidad de Berkeley, junto a San Francisco de California. Sin
embargo a partir de aquí se ampliarán bastante los centros de investigación.
No sólo en Dubna, cerca de Moscú, se monta un laboratorio para la síntesis
de núclidos, también el Instituto Nobel de Estocolmo y el CERN (Centro Europeo
de Investigaciones Nucleares) en Ginebra y Grenoble, se preparan
para lo mismo, y lo que es mejor, buscando nuevas rutas de síntesis.
Hasta ahora se había bombardeado núcleos
pesados con neutrones o con partículas alfa. )Por qué no intentarlo con núcleos
más pesados? Naturalmente al tener más carga deberían ser acelerados más
intensamente y por lo tanto necesitaban un cañón acelerador más potente.
Montados éstos, sólo tenían que empezar a disparar, esta vez con núcleos
como el boro 5, el carbono 12, el nitrógeno 14 y el oxígeno 16.
En 1958, en Berkeley se anuncia
el descubrimiento del elemento 102, y rápidamente se bautiza. Por concesión al equipo sueco que había iniciado
los trabajos de síntesis dos años antes, se le da el nombre de NOBELIUM,
con símbolo No en honor a Alfredo Nobel, el sueco descubridor de la dinamita
y fundador de la Institución Nobel.
La reacción de obtención del nobelio
por parte del equipo sueco, en 1957 fue:
244Cm96 + 13C6 =
253No102 + 4 (1n0)
y 244Cm96
+ 13C6 = 251No102 + 6 (1n0)
El período se semidesintegración de los isótopos
obtenidos, oscilaba sobre los 10 minutos.
Tres años después, en 1961, Ghiorso,
colaborador de Seaborg, anuncia haber obtenido el 103, bombardeando californio
con boro; lo denomina LAWRENCIUM, con símbolo inicial Lw y que después
pasó a Lr, por problemas alfabéticos internacionales. Ernesto Orlando Lawrence
[1]
, había sido el científico norteamericano, que
basándose en una idea de su colaborador, el noruego Wideroe, creó una forma
de acelerar las partículas con carga eléctrica en menos espacio, aprovechando
las trayectorias circulares que describen las partículas cargadas bajo la
acción de campos magnéticos e inventando el ciclotrón, tan necesario para
obtener los núcleos acelerados que permitieron la fusión fría y la obtención
de los nuevos elementos.
La reacción preparada fue la siguiente:
252Cf98 +10B5 = 257Lr103
+5 (1n0)
El equipo americano consiguió determinar
la química del metal partiendo de sólo cinco átomos.
El equipo ruso del profesor Flerov,
en las investigaciones para la síntesis del 104, lo consiguen en 1964 por
bombardeo de plutonio con núcleos de neón, según la reacción:
241Pu94 +22Ne10 = 260X104
+4(1n0)
denominando a X, KURCHATOVIUM
(Ku), en honor al científico Kurchatov, que había organizado la investigación
nuclear en Rusia.
)Cómo se realiza el bombardeo con
núcleos tan pesados? El blanco era una finísima hoja soporte de aluminio
impregnada de plutonio. Los proyectiles, núcleos rápidos de neón atraviesan
la capa de aluminio y se funden con los de plutonio. Sólo una proporción
de núcleos de 1 a 1010 sufre la transformación. Veinte átomos
de este elemento y una décima de segundo de vida, bastan al profesor checo
Nvara para determinar la química del elemento, que se parece a la de HAFNIUM.
Efectivamente su tetracloruro (KuCl4) casi tan volátil como el
HfCl4 y muy diferente a las
combinaciones de los ACTÍNIDOS, ya no correspondía al un elemento
5f, sino al de un 6d. Este elemento presenta una semivida relativamente
larga comparada con la de sus vecinos.
El antiguo NOBELIUM va a ser obtenido en Dubna (1958 y 1963) y en
Berkeley (1967), mediante las reacciones nucleares:
241Pu94
+16O8 = 254No102 +3 (1n0) 246Cm96 +12C6 = 254No102
+4 (1n0)
En ambos casos, los isótopos obtenidos
son alfa emisores, pero con una vida media extremadamente corta entre 2
y 40s, vida tan corta que impedía realmente su estudio. Sin embargo los
resultados no son coincidentes, ni entre ellos, ni con los obtenidos por
el equipo sueco, ni con los que se habían encontrado en 1957 y 1958.
Por otra parte el equipo de Flerov,
descubre que los americanos se habían equivocado al identificar al elemento
103, al igual que los suecos con el 102 y los redescubren en 1966, bombardeando
americio con núcleos de oxígeno, por lo que el Instituto Unido de Investigaciones Nucleares
(algo así como el CERN de los países del este) acuerda rebautizarlos. Así, el 102
[2]
, será el JOLIOTIUM con símbolo Jl (después
Jt), en honor a Federico Joliot, Nobel de Física, por su descubrimiento
de la radiactividad artificial junto con su esposa Irene Curie y dirigente
del partido comunista francés, y el 103, el RUTHERFORDIUM (Rf), en
recuerdo de Ernesto Rutherford, uno de los "padres de la investigación
nuclear".
Los americanos en 1968, bombardean californio con
carbono y también obtienen el 104, aunque con masa diferente (257), y para
contrarrestar a los rusos, le nombran RUTHERFORDIUM (Rf).
249Cf98 +12C6 = 257Rf104
+4(1n0)
)Qué va a ocurrir? Pues algo tan simple como que un mismo elemento tenga
nombre y símbolo diferentes, y que el mismo nombre pueda corresponder
a dos elementos distintos. Con esto comienza la batalla de los símbolos
y nombres en los elementos químicos; la guerra fría se propaga a la ciencia.
Esta guerra se recrudecerá en la
síntesis del 105. Esta vez los americanos creyendo que se adelantan a los
rusos, consiguen el 105 en abril de 1970, con californio 98 y nitrógeno
7. Lo nombran HAHNIUM, con símbolo Ha, en honor al "padre de
la bomba A", descubridor con Strassmann de la fisión de U235
249Cf98 +14N7 = 260Ha105
+4(1n0)
Pero
resultó que meses antes, en febrero, los rusos lo consiguen con americio
95 y neón 20, bautizándolo como NIELSBOHRIUM,
con símbolo Ns, otro de los "padres del modelo atómico", aunque
lo publicaran después.
243Am95 +22Ne10 = 261Ns105
+4(1n0)
Era la primera vez que a un elemento
se le daba el nombre y apellido de un científico. La confusión estaba servida.
Dado que los elementos descubierto
Ku/Rt o Ns/Ha, realmente son respectivamente EKA HAFNIUM y EKA
TANTALIUM, parece lógico que se encontraran en los residuos de sus respectivos
"progenitores", o mejor dicho "hermanos mayores" (quizá
estuviera mejor dicho menores, en función de su masa atómica y composición
nuclear y electrónica). Desde el año 1966 y 1970 se investigaron esas posibilidades
publicándose algunos trabajos sin confirmación, dado que teóricamente las
menas habituales deberían contener una parte entre 1015, del metal normal,
lo cual lo hacía prácticamente inaprovechable.
Incluso si lo hubiera en cantidad suficiente, podría producirse la fisión
espontánea provocada por alguna partícula errática
[3]
,.
Se produce un cambio en la técnica de síntesis
de nuevos elementos, que coincide con la puesta en marcha de dos nuevos
centros de investigación, el de Darmstadt, con su acelerador UNILAC (acelerador
lineal universal) en Alemania y otro en Estados Unidos, en Oak Ridge. Surge
la fusión fría para evitar que el núcleo esté tan excitado que se rompa
antes de fusionarse. Es evidente que los núcleos al recibir partículas con
gran energía, la disipan girando a gran velocidad; este giro, según el modelo
nuclear de la gota líquida, modifica la forma del elipsoide, hasta formar
un cuello que permite llegar a fisionarse, no logrando el propósito de obtener
un núcleo más pesado. Sin embargo si se parte de núcleos muy estables y
esféricos como blancos y se les bombardea
con iones pesados más o menos estables, la pérdida de estabilidad absorbe
tal cantidad de energía que enfría el proceso, lo que impide la excitación
y por lo tanto, una ulterior fisión; es una fusión fría. Esta idea propuesta
por Yuri Oganessian, de Dubna, va a emplear blancos mucho más ligeros y
estables, como el plomo o el bismuto, y proyectiles más pesados, como los
iones cromo, manganeso y hierro. Así mismo se elabora un acuerdo por el
cual no se bautizará a ningún nuevo elemento que se descubra. Su número
atómico y su masa, será su única identificación.
)Pero cómo se pueden detectar elementos con períodos de vida cada vez
más cortos?
En Dubna se sigue el método de estudiar las huellas
de los procesos sucesivos de desintegración de cada elemento reconstruyendo
la cadena marcha atrás hasta alcanzar el original, combinado con lo que
llamaron termocromatografía gaseosa, que puso en marcha el profesor checo
Zvara, mientras que en Darmstadt, Münzenberg crea el SHIP, separador de
productos de iones pesados, basado en un selector de velocidades de retroceso
de los productos de la colisión. Este procedimiento es capaz de detectar
isótopos con vidas del orden del microsegundo.
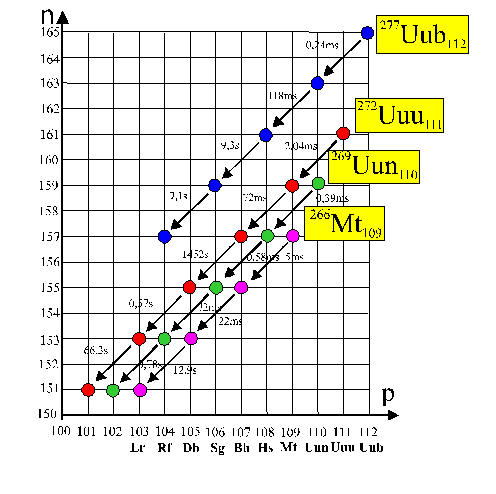
El 106 (un EKA WOLFRAMIUM)
se produce en 1974, en Berkeley bombardeando californio con oxígeno según
la vieja técnica:
249Cf98
+16O8 = 260X106 +5(1n0)
y el 107, en Dubna, en 1976, aprovechando
el montaje del acelerador de iones
pesados U-400
[4]
, con cromo
acelerado sobre blanco de bismuto según una fusión fría:
209Bi83 +54Cr24 = 261Y107
+2(1n0)
También
se sintetizará en Darmstadt, en 1981, por el equipo de Armbruster y Münzenberg,
que obtendrá el 29 de agosto de 1982, a las 16,10 horas, un único átomo
del 109 por reacción nuclear entre hierro y bismuto; sobrevivió 5 milisegundos.
209Bi83 +58Fe26 = 266Y109
+ 1n0
266Y109 = 262X107+ α
El 22 de marzo de 1984, Peter Armbruster,
director del laboratorio de iones pesados de Darmstadt, anuncia en París
la obtención de 3 átomos del elemento 108, sintetizado con hierro
y plomo, en el acelerador Unilac. Se trataba de una fusión fría:
208Pb82 +58Fe26 = 266Y108
= 265Y108 + 1n0
Como se observa, el isótopo 266,
está en un estado excitado al no liberar neutrones
[5]
, por eso se enfría eliminando un neutrón y
transformándose en el isótopo 265. Como el tiempo del enfriamiento es del
orden de 10-17s
prácticamente no se puede determinar el Y266.
Los núcleos de los elementos 107,
108 y 109, se desintegran por emisión α y no tienen fisión espontánea
como se esperaba.
)Cómo se arregla el problema de
los símbolos y de los nombres? Hay que darse cuenta, que si se usaba un
sistema periódico de un país de influencia rusa, los símbolos de los elementos
entre el 102 y el 105, eran los mencionados, y que diferían, si el sistema
estaba publicado o influido por la cultura científica norteamericana. Pues
bien, en 1976, la Comisión de Nomenclatura de Química Inorgánica, sección
de la IUPAC, consigue unificar criterios, de forma que a partir del elemento
103, último de los actínidos que será sólo el LAWRENCIUM, con símbolo
Lr, los nuevos descubiertos se nombrarán de forma sistemática, tomando prefijos
y sufijos latinos o latinizados. La equivalencia era: 0 = nil; 1= un; 2=
bi; 3= tri; 4= quad; 5= pent; 6= hex; 7= sept; 8= oct y 9= enn, todos ellos
con la terminación ium. Así el elemento 104 tendrá por nombre UN
(uno) NIL (cero, nada) QUAD (cuatro) IUM (final latina
de elemento, propuesta ya por Berzelius en 1832), o sea UNNILQUADIUM,
con símbolo Unq (se castellaniza a UNNILCUADIO), con el cual comienzan
a admitirse los de 3 letras. El 105, será el UNNILPENTIUM (Unp),
el 106 UNNILHEXIUM (Unh), el 107 el UNNILSEPTIUM (Uns), el
108 UNNILOCTIUM (Uno), y el 109 UNNILENIUM (Une).
La nueva nomenclatura preveía ya
hasta el posible elemento 900, que se llamaría ENNILNILIUM. Vamos
a generar el nombre y símbolo de un supuesto elemento de número atómico
126. Como se sigue el principio de construcción por fonemas con significado
numérico, tendríamos 1= UN, 2=BI, 6= HEX,y el final
IUM; sería el UNBIHEXIUM, con símbolo Ubh, )Y el bonito elemento 222? : sería
el BIBIBIIUM, con símbolo
Bbb. Así se podría nombrar a la carta cualquier elemento y establecer su
símbolo, siempre con tres letras.
Esta propuesta primero, recomendación después e imposición
más tarde, ha necesitado 10 años
para empezar a ser cumplida de forma que sólo en 1986 comenzaron a verse
sistemas periódicos con la unificación sistemática a partir del elemento
103. La revolución nominativa enterrará toda la etimología de los elementos
químicos. Se va a caracterizar por
dos premisas: la introducción de la sistemática en la nominación de los
elementos desterrando todo el romanticismo y el papel histórico de los nombres,
y la aplicación de símbolos de 3 letras.
Como los nuevos nombres no gustaban a nadie, y mucho menos a los
países que habían propuesto los antiguos, la IUPAC creó
la comisión Transfermium Work Group, que volvió a estudiar con todo detalle
la génesis de los nuevos elementos, investigando sus paternidades reales,
a fin del reconocimiento o no de los antiguos nombres de pila. Así, en septiembre
de 1992, se celebró en Darmstadt, la cuna de los post 106, la ceremonia
de rebautizo y asignación de Aacreditación de origen@, que quedó como sigue:
El 102 descubierto primero en Dubna, será el JOLIOTIUM (Jt).
El 103 será el LAWRENCIUM, Lr (propuesto y descubierto en Berkeley).
El 104 será el KURCHATOVIUM (Ku),
El 105 también descubierto en Berkeley, será el HAHNIUM (Ha)
(Se alternan los nombres americanos
y rusos).
El 106 todavía quedará innominado, aunque se atribuya a Berkeley,
permaneciendo como ejemplo antiguo
y será UNNILHEXIUM
El 107 es el NIELSBOHRIUM (Ns), en honor del físico danés Niels
Bohr
El 108 el HASSIUM (Hs), por la región de Hasse, donde se encuentra
Darmstadt
El 109 el MEITNERIUM (Mt) recordando a la austríaca Lise Meitner,
colaboradora de Otto Hanh en el descubrimiento de la fisión nuclear, y trasmitidora
junto con Bohr, de dichos conocimientos a los norteamericanos e ingleses.
Estos tres últimos elementos fueron
sintetizados en Darmstadt por el equipo de Peter Armbruster.
)Qué había ocurrido? Que en el reparto
había perdido el equipo sueco de Estocolmo, y de esta forma nos hemos quedado
sin el recuerdo de Alfredo Nobel y
sin el NOBELIUM, elemento 102, cuyo nombre y símbolo habían permanecido
30 años en el sistema periódico. )Por qué? Por que su Nobelio cuando
fué bautizado, no era tal elemento 102. También desapareció el RUTHERFORDIUM.
Todavía no ha terminado aquí el
asunto. En 1994, ha sido sustituido el nombre de UNNILHEXIUM (106),
el único que quedaba con la nomenclatura sistemática, por SEABORGIUM, Sg, en honor de Seaborg,
Nobel de Química de 1951, profesor norteamericano que se destacó
en las primeras investigaciones sobre los elementos actínidos y que creó
los equipos especializados en elementos superpesados de Berkeley y después
de Stanford. De esta manera, la nomenclatura propuesta por la IUPAC prácticamente
murió sin haberse dado a conocer, pese a que se estableció hace casi
30 años. Pero todavía nos esperan más sorpresas.
En Agosto de 1994, se reúne la
comisión de Nomenclatura de Química Inorgánica de la IUPAC, compuesta por
20 miembros de diferentes países presididos por el profesor australiano
Sargeson, determinando por votación
mayoritaria, que los elementos transfermios deberán llamarse:
Z
Símbolo Nombre Votos
101
Md MENDELEVIUM
20
102
No NOBELIUM
20
103
Lr LAWRENCIUM
20
104
Db DUBNIUM
19
105
Jl JOLIOTIUM
18
106
Rf RUTHERFORDIUM 18
107 Bh
BOHRIUM 20
108 Hn
HAHNIUM
19
109 Mt
MEITNERIUM
20
Antes,
en mayo de 1994, el equipo de Ghiorso, en Berkeley detecta un
átomo del elemento 110 cuando bombardea bismuto con cobalto, según la reacción:
209Bi83 + 60Co27
= 267X110 + 3(1n0)
En noviembre y diciembre de 1994,
en los laboratorios alemanes de Darmstadt, se logran detectar los elementos
110 y 111. Armbruster y Hofmann lo consiguen, bombardeando al estilo Dubna,
blancos de plomo o de bismuto con proyectiles de níquel acelerados por el
UNILAC, así:
208Pb82 + 62Ni28
= 269X110 + 1(1n0) y
208Pb82 + 64Ni28
= 271X110 + 1(1n0)
En el primer caso, detectan un
átomo del isótopo 269, y en el segundo cinco del 271. En un experimento
adicional, detectan 3 átomos del elemento 111 en una fusión fría estable
entre el bismuto 209 y el níquel 64, así:
209Bi83 + 64Ni28
= 272X111 + 1(1n0)
Estos isótopos presentan una vida
media de 0,17ms, en el caso del 110, y 1,5 ms para el 111, con emisión alfa
de gran energía. El centro de Darmstadt va a proponer para el primero el nombre de ARMBRUSTIUM, con símbolo Ab, que mucho
antes había sido del Alabamio, en honor a su director Peter Armbruster,
pero como se verá, no fue homologado, porque dicho director fue separado
de su equipo.
También en Dubna, Popeko y Yeremin
en colaboración con los físicos del Lawrence Livermore National Laboratory
de Estados Unidos, han logrado producir el elemento 110 a través de un
proceso de fusión en caliente:
244Pu94 + 32S16
= 273X110 + 3(1n0)
208Pb82 + 70Zn30
= 277X112 + 1(1n0)
Este elemento 112 emite partículas α de 11,6 y11,4 MeV , con un período de vida de 240 y 430 micro segundos, para producir los elementos 110 y 108, respectivamente; será por el momento un UNUNBIUM, hasta que se le atribuya el nombre IUPAC.

Las cadenas de desintegración radiactiva
de los últimos elementos sintetizados en Darmstadt, son las siguientes, que
terminan en elementos en los que se produce fisión espontánea, por regla general.
Todos estos últimos elementos a
partir del 104, serían unosTRANSLAURENCIOS y no corresponderían a las
series de transición interna (4f y 5f), pero, )los anteriores son realmente ACTINOIDES
o ACTÍNIDOS?

Se han estudiado de forma comparada
todas sus propiedades, y real-mente aunque muchas de ellas coinciden con las
de las tierras raras, otras, particularmente los estados de oxidación, difie-ren
de forma total. En aquéllas era normal encontrar un estado de oxidación 2+
o 3+, lo cual era lógico pues por su configuración electrónica 4fn5d16s2,
sus electrones externos eran 2 o 3. Esto no ocurre cuando los electrones aparentemente
entran a completar el orbital 5f. Algunos elementos se comportan ciertas veces
como EKA LANTÁNIDOS o EKA LANTANOIDES, mientras que los vecinos lo hacen como
metales de transición. )Por qué estas anomalías?
La clave está en los valores energéticos
de los orbitales 4f, 5d y 6s, así como la diferencia entre ellos, y la
de los orbitales 5f, 6d y
7s. Observemos la gráfica energía/Z, para los diferentes orbitales.
Como podemos observar, la serie
lantánida como se dijo, comienza a partir del elemento Z=58, porque en el
anterior, el nivel energético 5d está por debajo del 4f, invirtiendo la
regla n+l. Esta situación se va a repetir en la serie actínida, con el elemento
90, en el que comienza a llenarse el orbital 5f, aunque antes, en el 89
se había invertido el orden energético, entrando en el 6d.
Ahora bien, si nos fijamos en las pendientes de las rectas que nos
dan la variación energética con el número atómico, podremos observar que
en los actínidos son mucho menores que en los lantánidos, y por lo tanto
la diferencia energética entre los niveles 5f y 6d, es tan pequeña, que
los electrones pueden saltar de uno a otro en función de las necesidades
de formación de compuestos. Por eso, mientras que los estados de oxidación
de los 4f, son muy constantes (3+ y 2+), los de los
actínidos son muy diferentes, con
lo que la química también lo será. De esta forma no van a aparecer
los problemas de separación y aislamiento
que tuvieron lugar en la serie lantánida.
Las distribuciones electrónicas
de los elementos quedarían como siguen:
La
nueva modificación se debió a
la no homologación del Seaborgium, la reducción del nombre Nielsbhorium, para
que un elemento nunca fuera llamado con nombre y apellido, lo cual era una
revolución y el consensuado cambio del Kurchatovium, el científico ruso Apadre@ de la investigación nuclear en la URRS, por el
nombre del laboratorio, también ruso donde se habían efectuado los descubrimientos
(Dubna, cerca de Moscú). La vuelta del Nobelium, tan injustamente tratado
y los desplazamientos del Joliotium, del 103 al 105, y del Hahnium, del 105
al 108. Los perjudicados son los alemanes del laboratorio de Darmstadt, que
pierden el nombre de Hassium (Ha), antes 108, en favor de Hahnium, nuevo 108.
Pero todo quedaba en casa, pues Otto Hahn, también era alemán.
No terminaría aquí la deliberación
de la comisión correspondiente de la IUPAC, y para resolver todas las tensiones
existentes, acuerda en agosto de 1997 fijar permanentemente los nombres de
los elementos 104 a 109, como sigue:
104
Rf RUTHERFORDIUM
105
Db DUBNIUM
106
Sg SEABORGIUM
107
Bh BOHRIUM
108
Hs HASSIUM
109 Mt MEITNERIUM
| Z |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
| Nombre |
TO-RIO |
PROTO ACTI-NIO |
URA- NIO |
NEP- TU- NIO |
PLU- TO- NIO |
AME-RI-CIO |
CU-RIO |
BER- KE-LIO |
CALI-FOR- NIO |
EINS-TE-NIO |
FER-MIO |
MEN- DELE- VIO |
NO- BE- LIO |
LAU REN- CIO |
| Símbolo |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
| Electrones Externos |
7s2 6d1 5f1 |
7s2 6d0 5f3 |
7s2 6d0 5f4 |
7s2 6d0 5f5 |
7s2 6d0 5f6 |
7s2 6d0 5f7 |
7s2 6d1 5f7 |
7s2 6d0 5f9 |
7s2 6d0 5f10 |
7s2 6d0 5f11 |
7s2 6d0 5f12 |
7s2 6d0 5f13 |
7s2 6d0 5f14 |
7s2 6d1 5f14 |
| Grupo |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
| Z |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
111 |
112 |
| Nombre |
RUTHERFORDIO |
DUBNIO |
SEABORGIO |
BOHRIO |
HASSIO |
MEITNERIO |
UNUNNILIO |
UNUNUNIO |
UNUNBIO |
| Símbolo |
Rf |
Db |
Sg |
Bh |
Ha |
Mt |
Uun |
Uuu |
Uub |
|
Electrones externos |
7s2 6d2 5f14 |
7s2 6d3 5f14 |
7s2 6d4 5f14 |
7s2 6d5 5f14 |
7s2 6d6 5f14 |
7s2 6d7 5f14 |
7s2 6d8 5f14 |
7s2 6d9 5f14 |
7s2 6d10 5f14 |
Las propiedades químicas del seaborgio,
estudiadas en 1997, han indicado un comportamiento similar al molibdeno
y al wolframio elementos del grupo 6Antes se sabía que el dubnio, formaba
pentabromuros como el niobio, mientras que el rutherfordio daba lugar a
tetrabromuros como el circonio
[1]
El apellido Lawrence,
que da nombre al elemento, tal
como el nombre español, Laurencio, son de origen latino, referidos inicialmente
a los habitantes del Lacio.
[2]
La química en disolución del NOBELIUM ha empezado a
ser conocida en cuanto se obtuvieron 50.000 átomos del isótopo 255, confirmándose
que su estado más estable es el No2+ , lo que corresponde a
un orbital completo 5f14, con lo cual se demostraron las teorías
de Seaborg.
[3] En la Tierra hay conocimiento de reactores nucleares naturales que tuvieron lugar durante su formación. Algunos se han mantenido, como los 14 de Gabón, descubiertos en 1972 en el poblado de Oklo, desde 1970 millones de años hasta un millón de años después. Tuvieron que darse una serie de circunstancias para su funcionamiento: un filón de uranio enriquecido excepcionalmente en U235 y abundancia de agua subterránea que moderase los neutrones.
[4]
Mientras que el
U-400 era un ciclotrón de 4m de diámetro, el
UNILAC alemán era un acelerador
lineal de 113m de longitud.
[5]
La liberación de
neutrones se emplea para eliminar energía del núcleo obtenido, fundamental
para que no se rompa, por eso los proyectiles empleados en los cañones
deben ser isótopos con mayor número de neutrones.