
Publicación de su trabajo fundamental

Publicación de su trabajo fundamental
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Nace el 6 de enero de 1921, en
San Petersburgo. Hija de Wladimir Grunberg,
agente de publicidad artística y de Catherine Riasanoff,
que había terminado estudios de arquitectura y junto con su marido sentían una
gran pasión por el arte. Al poco de nacer
[1]
, su
familia emigró a Francia donde vivieron en la pobreza y de forma bastante
bohemia
[2]
.
Marianne completó el bachillerato en Niza
[3]
. A
los 17 años obtuvo el título de bachiller en matemáticas y filosofía. No tuvo
muy claro qué hacer a continuación. Dudó entre periodismo, arqueología y
crítica de arte. Obtuvo un certificado de literatura comparada y se matriculó
en la escuela de arquitectura, pero la guerra le impidió continuar los estudios.

Marianne en la universidad de Urbana
Realizó sustituciones de profesores de matemáticas y ciencias naturales en Nimes, lo que despertó su interés por la ciencia y acabó estudiando Ciencias Naturales. Estudia Ciencias Naturales en la universidad de París, graduándose en 1943.
Se sintió a gusto estudiando Ciencias Naturales y en particular Biología marina, y consigue matricularse para hacer un doctorado en el Laboratorio de Biología Marina de Roscoff y trabajar en el laboratorio de E.Abel del Instituto de Biología y Fisico-Química de París. Se doctora en 1947 con un trabajo sobre” La acción del oxígeno sobre el metabolismo intermedio de bacterias estrictamente anaeróbicas gram positivas y negativas”
En 1948, se casa con un pintor Armand Manago Guerin [4] , con el tendrá 2 hijos, Catherine y Michel, y se van a vivir a Urbana, cerca de Chicago [5] .
En 1953 obtiene una beca Fullbrigth,
ampliando su formación en enzimología en el laboratorio de Irwing Gunsalus, en la universidad de Urbana. Después se
incorpora al laboratorio de Severo Ochoa
[6]
en
Nueva York. El profesor Severo Ochoa estaba interesado en estudiar el mecanismo
de la fosforilación oxidativa, encargando a Marianne y a su compañero Erni Allen, que trataran de identificar un compuesto
intermedio utilizando fosfato radiactivo, y trifosfato de adenosina en
extractos del Azobacter Vinelandii. Mientras Ernie se
decantó por el estudio del compuesto final de la fosforilación, el acetilfosfato, Marianne se centró en el proceso mismamente.
Para ello, utilizó extractos de Azetobacter vinelandii tratando
de buscar nuevos coenzimas fosforilados, empleando para ello una reacción de
intercambio entre el ATP y el fosfato orgánico.
Cuando en 1955 realizó los ensayos utilizando una mayor cantidad de trifosfato de adenosina de partida observó, en el producto de reacción, pequeñas cantidades de difosfasto de adenosina como resultado de la hidrólisis del trifosfato (no se observaba esto si se partía de difosfasto de adenosina pur) que, luego por liberación de fosfato inorgánico, originaba la formación de un polímero de ácido poliadenílico constituido por un gran número de residuos de AMP, contando con todas las propiedades de un ácido ribonucleico.
Lo publica junto con Severo Ochoa en el Journal American Chem. Society “ Enzymatic synthesis and breakdown of polinucleotides; polinucleotide phosphorylasa” y junto con Priscila Ortiz en la revista Science [7] .
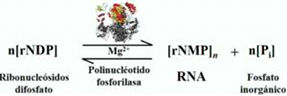
Reacción de producción de la PNPasa
Ochoa le ofrece el quedarse en su laboratorio, pero como estaba embarazada de su primer hijo, Catherine, decide volver con la familia a París. Igualmente rechaza la posibilidad de impartir enseñanza presencial en Harvard en 1958. incorporándose a Institut de Biologie Physico-Chimique.
De
vuelta en Francia, pasa a liderar un laboratorio de
investigación en bioquímica en 1959 y
posteriormente, obtener un grupo propio de investigación en bioquímica en 1967, en el IBCP, en el cual seguiría investigando
y estudiando las propiedades y funciones biológicas de la PNPasa en eucariotas y procariotas (sobre todo en E. coli y B. subtilis) así
como en la justificación de muchos pasos de la traducción genética como
la “iniciación” de las cadenas de proteínas, el papel de los ribosomas o
las interacciones codón / anticodón. Esto lo compaginó con su puesto como directora de investigación del CNRS que obtuvo en 1961.
En 1967, consigue la plaza de profesor asociado de Bioquímica en la Universidad de Harvard y de la Universidad de París, desde el 1977 al 1982. Por sus más de 300 artículos publicados y por el logro de sus investigaciones, le fueron concedidas numerosas nominaciones a premios, honores y distinciones [8] .
Estructura de la PNPasa de Marianne Grunberg
Recibió el premio “Charles Léopold Mayer” por su trabajo en la síntesis de polirribonucleótidos y su papel en la síntesis de las proteínas. Fue la primera mujer en impartir clases en Bethesda (NIH), primera mujer al frente de la Unión Internacional de Bioquímica de 1985 a 1988, y sobre todo primera mujer presidenta de la Academia de Ciencias del Instituto de Francia de 1995 a 1996 (honor denegado a Marie e Irene Curie) [9] .
Desde 1964 pasa a ser miembro de EMBO, la Sociedad Americana de
Química Biológica y
muchas academias extranjeras, entre ellas la Academia
Nacional de Ciencias de los Estados Unidos (1982), la Academia de Ciencias
de Rusia y la Sociedad francesa de Bioquímica y Biología molecular en 1985.
En 2008 es nombrada Gran Oficial de la Legión de
Honor, condecoración que le conceden.
Además destacar su labor divulgadora a través de su trabajo como editora jefa de la revista
“Biochimie” de la Sociedad Francesa de Bioquímica y Biología Molecular durante
la década de los ochenta y su labor conciliadora con los países de la
guerra fría, lo que permitió facilitar el fomento de contactos entre
laboratorios europeos y rusos, en períodos de gran escasez financiera y
académica.
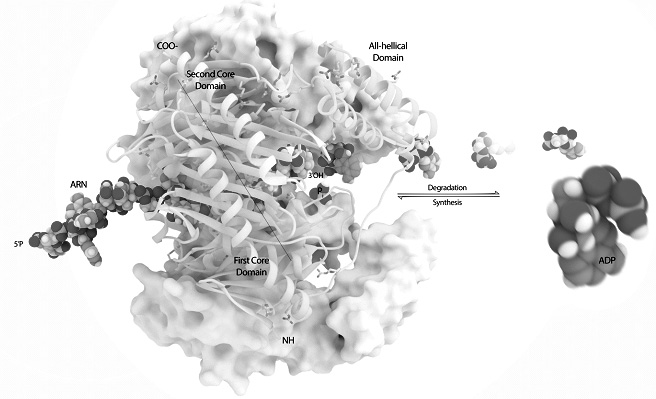
La enzima de Grunberg-Manago la ARN polimerasa, fue fundamental para descifrar el código genético con lo que Ochoa y Kornberg ganaron el Nobel de Fisiología en 1959. A Marianne Grunberg-Manago, ni la nombraron. La molécula aislada en 1955, se formaba a partir de tres unidades iguales configurando un conducto estrecho donde se puede acoplar la cadena de ARN.

Marianne en París

Marianne en el 2000
NOTAS FINALES
[1] Marianne tenía 9 meses.
[2] En su autobiografía cuenta que su madre tuvo que hacer de maniquí, mientras que su padre, aparte de participar en la edición de libros de arte, tuvo que hacer de violoncelista, figurante de cine
[3] Eran tan pobres que a los 12 años para que estudiase los profesores le prestaban los libros , sobre todo diccionarios, pues no tenía dinero para comprarlos.
[4] Fallecerá 30 años antes que ella.
[5] Cuenta ella: “Aquí estamos, en Illinois, donde mi esposo pinta los cuadros sobre París”.
[6] Lo había conocido por intermediación de su jefe de laboratorio Eugene Abel, en su primera etapa de investigación, cuando estaba haciendo el doctorado.
[7]
Marianne Grunberg-Manago descubrió una enzima muy peculiar que daría alguna alegría a la biología
molecular. Una enzima que hacía desaparecer el ADP de la muestra de estudio y
la volvía más turbia. Se tardó meses en caracterizar la sustancia que resultaba
de la desaparición del ADP que resultó ser un polímero de adenina, una de las
bases presentes en el ADN y ARN (poliA), en este caso
un poliARN. Había aparecido una de las moléculas de
moda tras la irrupción de la doble hélice de ADN de Watson y Crick en 1953. Con
gran tesón y suerte habían aislado una proteína que catalizaba la síntesis de
polinucleótidos a partir de nucleótidos como ADP. Esto era una cosa importante,
no se conocía ningún sistema que sintetizara ARN y se buscaban con ahinco las creadoras de las moléculas guardianas de la
información genética, del ADN y ARN, la pega es que lo hacía de novo, no necesitaba una plantilla que copiar, no era
la sintetasa buscada. Con todo, tuvieron mucha fortuna, in vivo este
enzima degrada el ARN no lo crea, pero en esas condiciones in vitro con
nucleótidos difosfato y muy poco fosfato, la reacción discurría ‘al revés’,
creaba cadenas de nucleótidos.
[8] Decía: “Un investigador debe ser un creador, como un pintor , poseer una buena dosis de intuición, una gran honestidad y un formidable rigor”
[9] “Yo soy la revancha de María e Irene Curie”, diría después de su nombramiento con voz clara y fuerte. Su sobre nombre en la Academia era “Primero, si no te importa”. A lo largo de su historia la presidencia de la Academia francesa de Ciencias fue de 4 mujeres y 132 hombres.

Marianne presidenta de la Academia francesa
Mecanismo de la enzima Grunberg-Manago
En el
año 2000, Marianne sufre una hemorragia cerebral que la origina una gran merma
en sus capacidades y habilidades físico-psíquicas que desencadenaría en
su muerte, 13 años después, la
madrugada del 4 de enero de 2013.
De
ella quedará además de toda su labor académica y profesional, su gran atractivo
personal, su carácter apasionado y enérgico que además de aumentar su interés
por la expansión del conocimiento científico.