
Fotografía 1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
CORAZÓN PULSANTE DE MERCURIO
Introducción
Con este nombre tan sonoro se conoce a un proceso químico mediante el cual puede hacerse vibrar a una
gota grande de mercurio, adquiriendo
formas diversas tal como puede observarse
en las fotografías de este artículo.
El análisis de las reacciones químicas y el
proceso para lograr la oscilación mecánica aparece en numerosos libros de
Demostraciones Químicas, entre otros (1), (2) , (3), (4).
Un análisis completo de las reacciones y su origen histórico puede encontrarse en un trabajo recientemente publicado (5).
El proceso químico es espectacular, relativamente
fácil de hacer por parte del Profesor y, por tanto, perfectamente adecuado para motivar a los alumnos.
Material
Vidrio de reloj
Soporte para mantener fijo el vidrio de reloj
(por ejemplo un aro o un soporte de
corcho)
Mercurio
Disolución de K2CrO4 (
Disolución de
H2SO4, aproximadamente
Un clavo de hierro
Soporte y pinza de bureta para sostener el clavo.
Procedimiento
1) Se prepara el clavo sujetando su cabeza mediante la pinza de bureta
(fotografía 1)
El clavo se sujeta con la pinza de bureta y se le da una inclinación
de unos cuarenta y cinco grados.
1) En el vidrio de reloj se coloca algo de mercurio.
Observado éste desde la parte superior aparece como un círculo, cuyo
diámetro debe ser algo menor de dos centímetros.
La gota grande de mercurio colocada en el vidrio
de reloj. Vista desde arriba tiene forma circular
(fotografía 2)

Fotografía 1
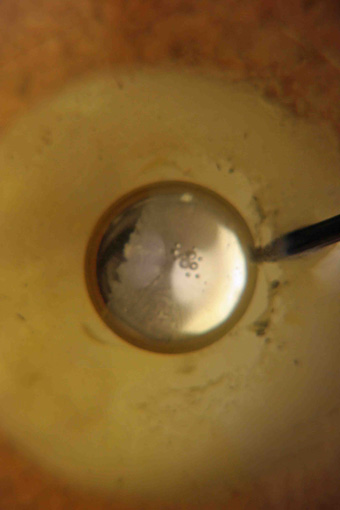
Fotografía 2
2) Se añade la disolución ácido sulfúrico hasta
cubrir completamente el mercurio y a continuación unas gotas de la disolución
de cromato de potasio. Se observa una coloración anaranjada, probablemente
dicromato, que luego desaparece, quedando la disolución ligeramente amarilla
y la gota sufre como un aplanamiento y se cubre de una fina capa opaca. Se
sumerge la punta del clavo en la disolución y poco a poco se acerca a la gota, se toca ligeramente
al mercurio y de inmediato se separa
de él algo menos de un milímetro.
Debe comenzar la oscilación mecánica, al principio
es una rápida vibración sin que se altere la forma de la gota, pero al cabo del tiempo aparecen otras formas tales como las que pueden verse en las fotografías.
El paso de una forma a otra de la gota es muy rápido. A medida que transcurre el tiempo, las vibraciones son cada vez menos violentas
y la forma del mercurio es circular sin que aparezcan otras formas. Parece
como si el corazón pulsante de mercurio fuese
apagando sus latidos.
A veces la oscilación se resiste a aparecer,
por tanto, el Profesor debe intentar la operación de nuevo, ajustando la distancia entre clavo y gota y variando
la inclinación del clavo. Sin que sepamos por qué, son importantes para lograr
la oscilación: la distancia entre la
punta y el mercurio y el ángulo de
la punta (de unos 45º) con la horizontal.
La colocación de la punta debe hacerse por un
lado de la gota y no por encima de ella.
Una vez conseguida la oscilación suele mantenerse durante bastante tiempo, pero
a veces se detiene de forma inesperada.
En esta serie de
fotografías (3 a 8) se observan diferentes formas que adquiere el mercurio durante
su oscilación
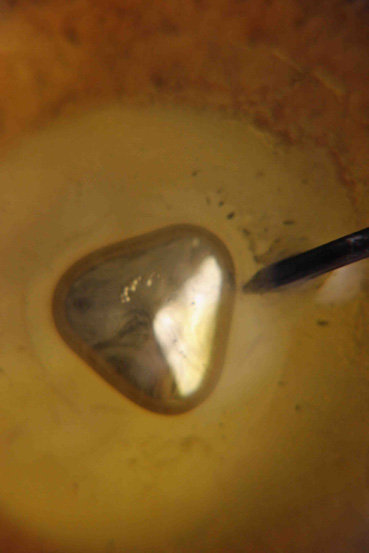
Fotografía 3
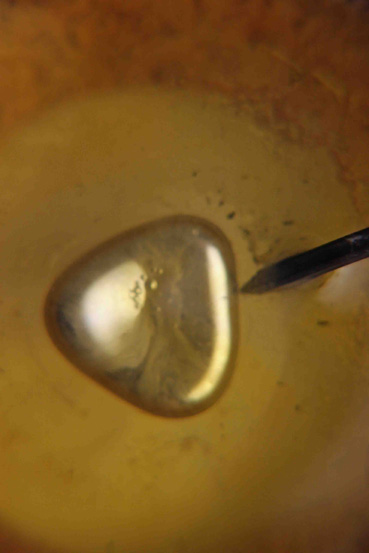
Fotografía 4
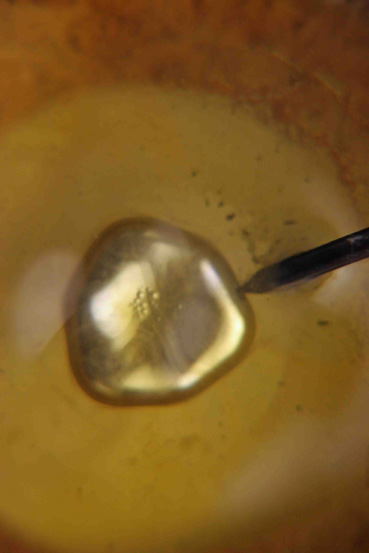
Fotografía 5
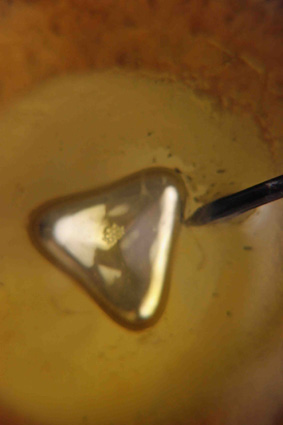
Fotografía 6
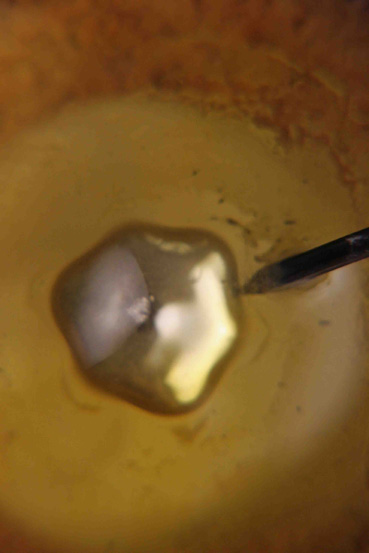
Fotografía 7
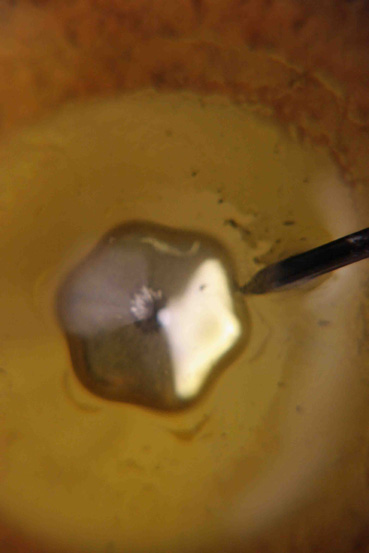
Fotografía 8
Presentación
del fenómeno
Si el número de alumnos es pequeño lo mejor
es la observación directa. Si el número es grande,
es muy recomendable utilizar una filmación con cámara de video o emplear la
web-cam de un ordenador. Nosotros hemos empleado este último procedimiento
y aseguramos que el fenómeno se observa perfectamente. La imagen captada se
puede proyectar sobre una pantalla mediante un cañón, o bien mostrarla en
una pizarra digital.
Posible
mecanismo del proceso
Para lograr el proceso todos los libros coinciden
como reactivos necesarios, un agente oxidante, cromato, dicromato o agua
oxigenada en medio ácido y en un clavo de hierro.
La explicación proporcionada por el autor de la referencia (1) es la siguiente:
El mercurio, tiende a formar gotas de forma
esférica debido a la tensión superficial, si por algún procedimiento esa tensión
superficial disminuye la gota tiende a aplanarse. La tensión superficial del
mercurio depende de la carga de sus gotas, si ésta es positiva la tensión
superficial es baja y si es negativa es alta.
El cromato en medio ácido reacciona con el mercurio
según la reacción:
![]()
Esta reacción supone transportar cargas negativas desde el mercurio a la solución
y como consecuencia quede un remanente de carga positiva en el mercurio,
la cual determina un aplanamiento de la gota .Cuando la gota toca al hierro
el mercurio se reduce de nuevo a mercurio metal
![]()
Ahora el proceso consiste en transferir electrones
al mercurio y restablecer su tensión superficial por lo que la gota se contrae y se rompe el contacto con el hierro. El proceso
se repite y es lo que da lugar a las
vibraciones.
Que nosotros sepamos nadie ha hecho un estudio
cuantitativo de la procedencia de la energía que se necesita para hacer vibrar
el mercurio, lo que se dice es que la energía debe proceder de la reacción
química, lo cual parece evidente.
Alguna reacción más debe ocurrir en el proceso,
pues aparecen pequeñísimas burbujas
de gas, lo cual puede explicarse por la reacción entre el hierro y el ácido
sulfúrico.
De todas formas ante un proceso químico y la
complejidad de las reacciones, creemos que las explicaciones siempre son incompletas.
(1)
B.Z Shakhashiri .Chemical Demonstratión. (A handbook for teacher of chemistry).
The
(2) Lee.R.Summerling , James.L. Ealy
Jr. Chemical Demonstrations. American
Chemical Society.1988
(3) Leonard
A. Ford. Chemical Magic.
(4)
Philip S. Chen. Entertaining and Educational Chemical Demonstrations. Chemical Elements
Publishing.Company 1971.
(5)
María Teresa Martín Sánchez y Manuela Martín Sánchez. Anales
de Química Volumen 106, Nº 4. Octubre –Diciembre 2010.
Nota.- El mercurio utilizado en
el experimento queda cubierto por una capa menos brillante que el metal. En
un vaso añada sobre él, ácido nítrico
concentrado e inmediatamente agua
abundante. El mercurio recupera su brillo. Lave con más agua. Decante la disolución
diluida ácida que ya es prácticamente agua , seque el resto con papel de filtro
y así recupera el mercurio y no producirá residuos.