
Fig.1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Pilas electroquímicas
Cu/Pb y Pb/Zn
Hemos
estudiado la pila Daniell, con los pares metálicos
Cu y Zn (PQ-27, en esta web). Ahora vamos a comparar los resultados obtenidos
al enfrentar dichos metales frente a otro elemento el
Pb, para comprender mejor las tendencias a perder o ganar electrones de unos
metales frente a otros.
Para ello se realizará el montaje que
se observa en la fig1. Un vaso de precipitados pequeño (100mL), con una disolución
de sulfato de cobre(II) aproximadamente 1M, en el que se sumerge una lámina
de cobre, y otro vaso de precipitados similar en el que se dispone una disolución
de nitrato de plomo(II) también 1M, unidos ampos por un puente de papel de
filtro. La barra de cobre se conecta al polo positivo del voltí-metro por
el cable rojo y la lámina de plomo al polo negativo por el cable azul (si
se conectan al revés, indicaría una ddp negativa). Al conectarlos el voltímetro
no señala diferencia de potencial, debido a que el papel de filtro no se ha
impregnado de disolución salina, con lo cual no hay circulación de iones.

Fig.1

Fig.2

Fig.3
Se moja con un cuenta gotas el papel
de filtro y ya se observa la indicación del voltímetro 0,32 V.(fig.2 y detalle
en fig.3) ( por debajo de lo que debería marcar en condiciones estándar 0,46V.
Dado que el potencial de reducción de
Cu2+/Cu es superior al del Pb2+/Pb, los procesos que
tienen lugar, implican que los electrones circulan desde el Pb al Cu, por
lo que la barra de plomo irá disolviéndose, aumentando la concentración de
Pb2+, mientras que el Cu2+, al tomar 2 electrones se
irá depositando como Cu metálico en
la barra respectiva (figs.4 y 5) (este hecho sólo se observaría al cabo de
bastante tiempo). La hemicelda del Pb/Pb2+, será el ánodo ya que
ocurre una oxidación, mientras que la Cu2+/Cu será el cátodo, pues
tiene lugar una reducción.
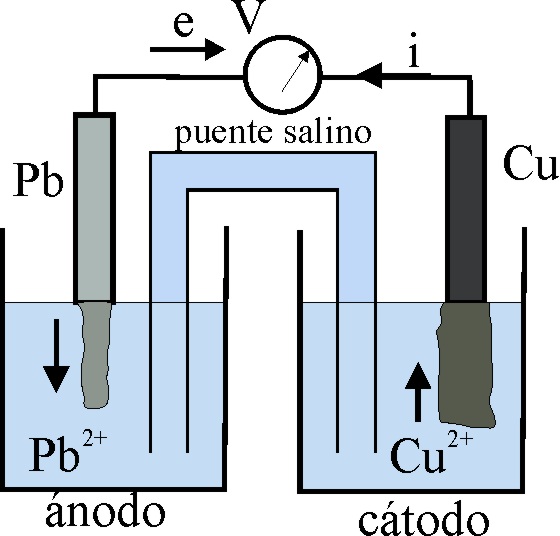
Fig.4

Fig.7

Fig.8
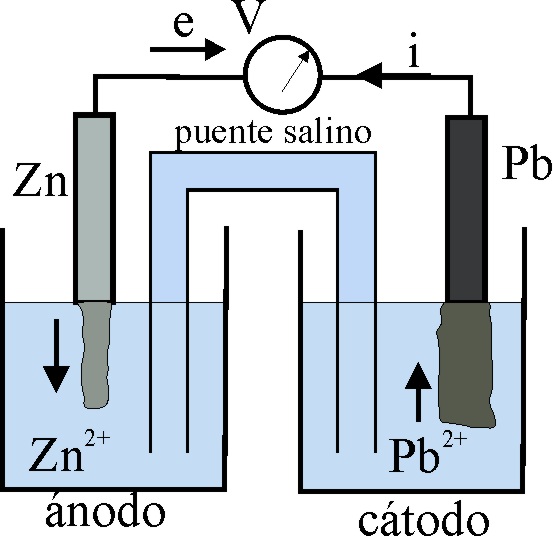
Fig.11
El esquema del proceso en la pila electroquímica
formada (dado en la fig 11), implicaría que al cabo
de cierto tiempo la barra de cinc se disolvería, aumentando la concentración
de iones Zn2+ en la disolución, y suministrando 2 moles de electrones
al Pb2+, para que se forme Pb, que se deposita sobre la barra correspondiente.
Si sumamos las
diferencias de potencial de ambos procesos:
Zn/Zn2+(1M) frente
a Pb2+ (1M)/ Pb = 0,64V y
Pb/Pb2+(1M) frente
a Cu2+(1M)/Cu= 0,32V
Tendríamos la
pila Daniell Zn/Zn2+(1M) frente a Cu2+ (1M)/ Cu, con una diferencia de potencial de 0,96V .

Fig.5
La
simbología de la pila electroquímica formada será la dada en la fig 6.
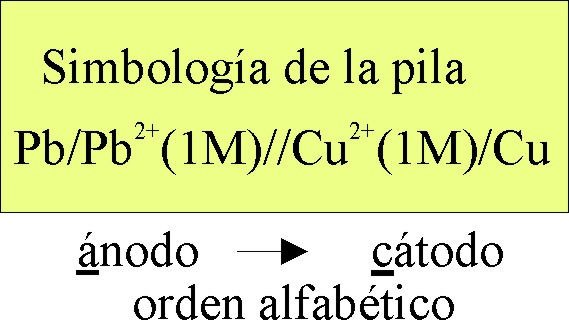

Fig.9
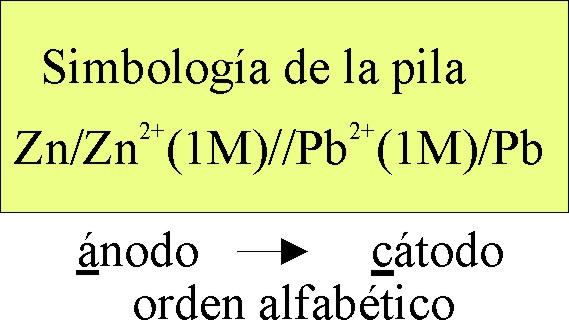
Fig.10