
Fig.1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Pilas electroquímicas con
objetos 5
Una vez obtenido el patrón plata a través una sortija, vamos a compararlo a través del par Ag+/Ag, con diferentes objetos metálicos. En la práctica anterior (Pilas electroquímicas con objetos 4), se comparó con una moneda de plata, con una lámina de plomo, otra de cinc. Ahora lo haremos frente al estaño.

Fig.1

Fig.2(ampliación)
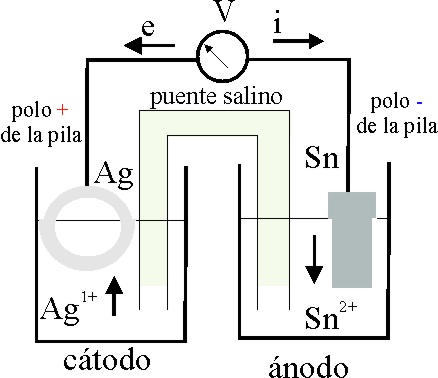
Fig.3

Fig.4
Teóricamente
la diferencia de potencial de la pila formada debería ser de 0,80-(-0,14)V=0,94V
(fig.4), en condiciones estándar, que no se dan en este caso por impurezas
del papel (Al).
El
proceso redox que tendría lugar sería (fig.5)
La
simbología de la pila electroquímica formada será la dada en la fig.6.
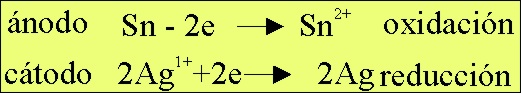
Fig.5

Fig.6
Podríamos hacer lo mismo con una moneda de cobre frente al papel de estaño.
El par Cu2+/Cu, presenta un potencial normal de 0,36V, mientras que el del Sn2+/Sn es de -0,138V.Al enfrentarlos lo que marca realmente el voltímetro es 0,53V (fig. 7 y 8). Debería marcar en condiciones normales 0,50V, pero por la anomalía citada antes, marca un poco mas.

Fig.7

Fig.8 (detalle)