Química del tornillo VII
Vamos
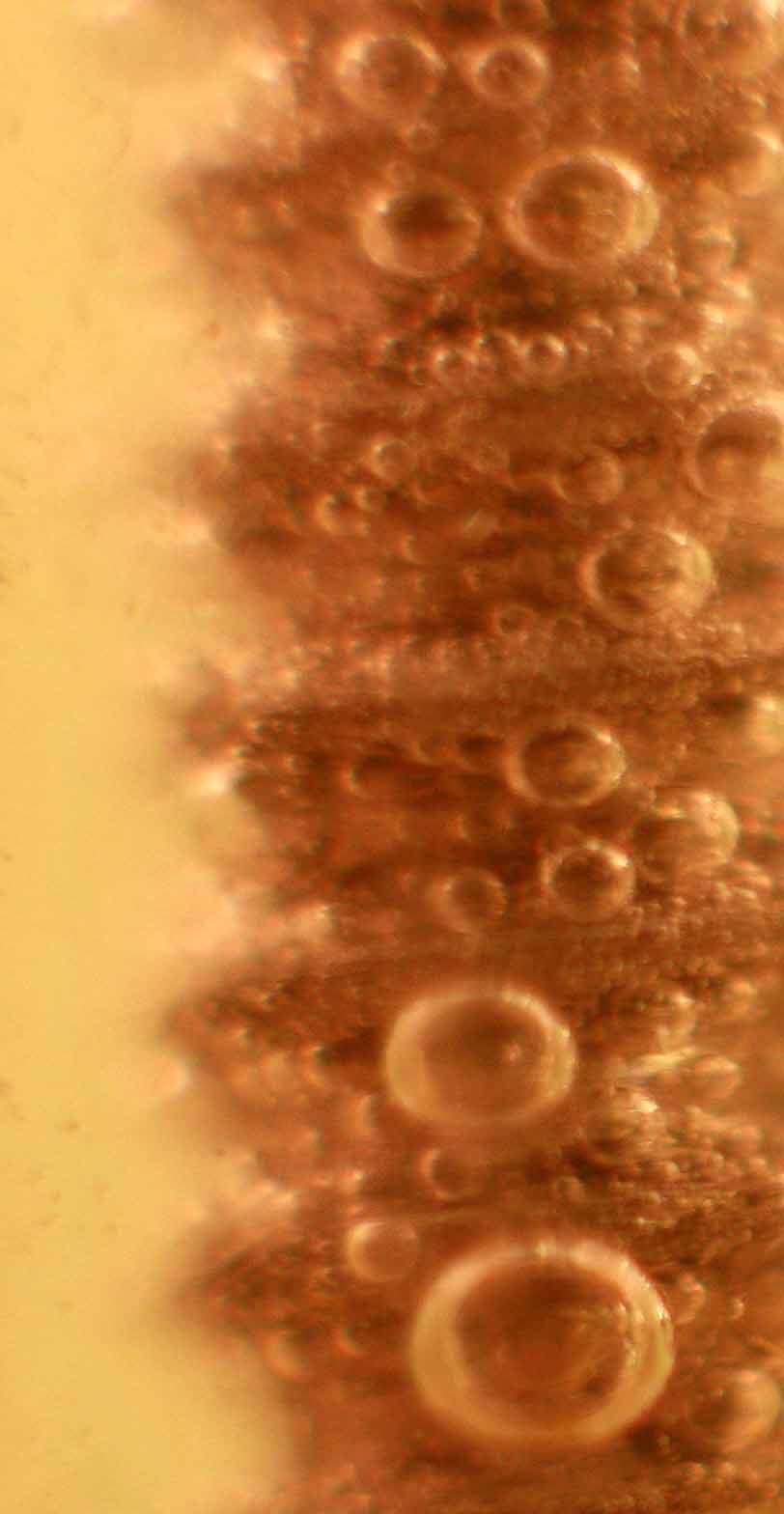
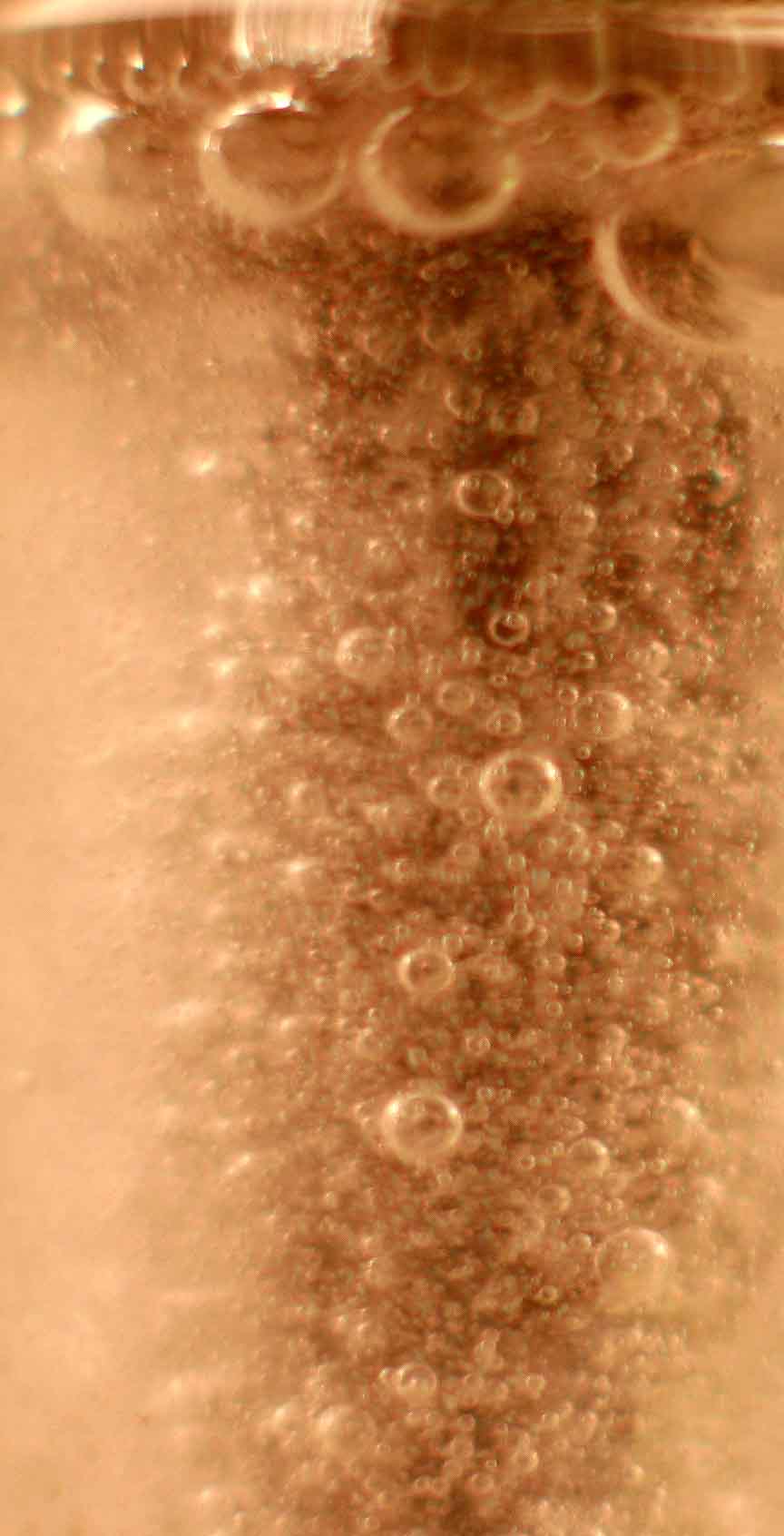
a introducir nuestro tornillo de hierro en una disolución saturada de cloruro de estaño(II) (foto 1). Al cabo de un tiempo muy corto, comienza
a producirse hidrógeno (foto 2) y a disolverse el hierro dado que los potenciales
normales de reducción del par Sn2+/Sn en medio neutro es -0,13V es muy superior al del Fe2+/Fe -0,44. Por este motivo la reacción que se
producirá espontáneamente es:
![]()
Formándose
una capa arborescente de estaño (árbol de Júpiter) sobre el tornillo, fotos 1 y
2 y disolviéndose el cloruro de hierro(II)