
Fig.1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Reacciones de
precipitación 9
Precipitación del Fe(II)
Primeramente sobre una disolución de sulfato de hierro(II), amarillo, que realmente es [Fe(H2O)6]SO4, echamos unas gotas de disolución de carbonato sódico, acentuándose inicialmente el color amarillo (fig.1), con algún desprendimiento de burbujas de CO2, formándose con el tiempo un precipitado marrón (fig.2). Al echar unas gotas de tiocianato potásico, pasa a un color verdoso (fig.3), a diferencia de lo que ocurría con el Fe(III). Diferenciándose la disolución verdosa del precipitado en el fondo marrón rojizo (fig.4, y 5).

Fig.1
Si ahora se echa un poco de cromato potásico que oxide el Fe(II a (Fe(III), o simplemente dejándolo un tiempo, el precipitado se transforma en rojo (fig.9)
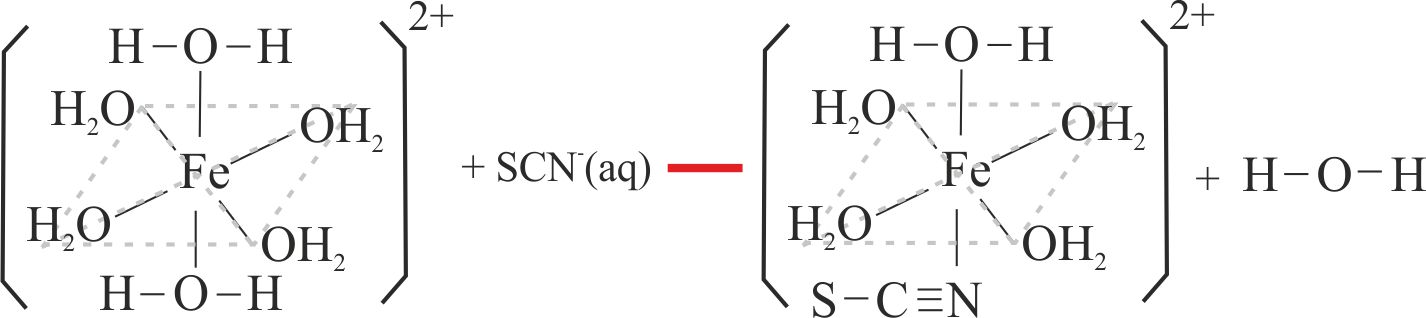
Fig.7
Como se ha explicado anteriormente los cambios de color se deben a la sustitución de los ligandos agua por los de tiocianato, o ciano (fig.7 y 8)

Fig.3

Fig.6

Fig.5 (detalle)
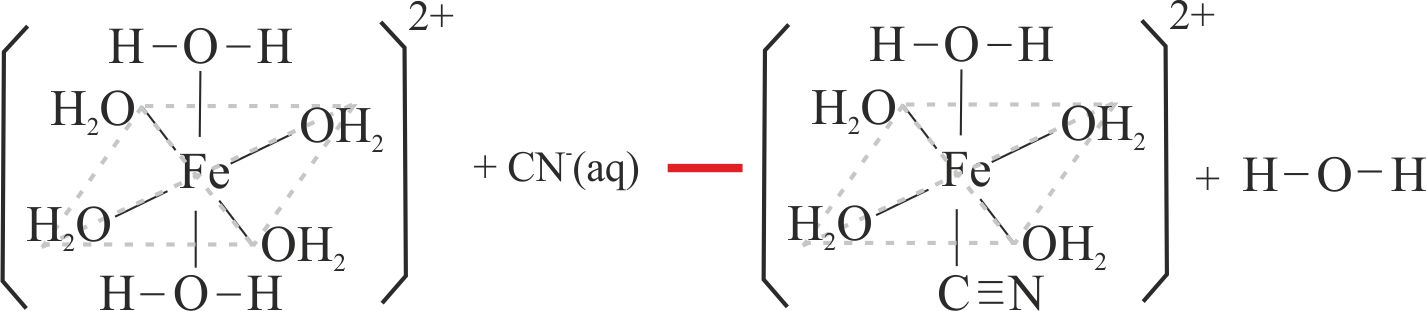
Fig.8
Con ferrocianuro de potasio el
color verdoso se transforma en azul oscuro (fig.6).
El problema de los cambios de color se explicó en su día en la sección de Química a la gota, complejos del hierro.
Al igual que ocurre cuando a otra disolución de sulfato ferroso se le echan unas gotas de ácido acetilsalicílico. En este caso el precipitado rojo se mantiene en la superficie(fig.10), debido a las burbujas de gas.

Fig.9

Fig.4(detalle)

Fig.10

Fig.2