
Fotografía 1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
PROBLEMAS VISUALES DE QUÍMICA
PVQG20-1*

Fotografía 1
En el embudo de decantación A, se disponen de agua destilada y en B, 4,0 g de carburo cálcico del 80% de
riqueza. Se abre la llave del embudo E y
el gas que se desprende se recoge sobre medio litro de agua, a
a)Si en el frasco invertido C se recoge etino ¿De qué tipo de reacción se trata? Formúlala y ajústala.
b) El etino, debido a su triple enlace, es ligeramente soluble en el agua (a 20ºC;0,12g/100mL) ¿Qué volumen ocuparía el gas residual liberado en C, en las condiciones dadas?
Datos.Masas atómicas : Ca=40, H=1, O=16. C=12. Presión del vapor de agua a 20ºC=17,5mmHg
R= 0,082 atm-L.K-1 mol-1
PVQG20-2 **
PVQG20-3***
Iones ferroso y férrico
Dispones en A (foto 1) de 20mL de disolución de sulfato de hierro(II)
2M, a la que agregas la cantidad suficiente de KOH en B, para que a reacción sea completa y la misma cantidad de
ferrocianuro potásico en C, ferricianuro potásico en
D y tiocianato potásico en E (fig.1) e igual se hace
con los mismos reactivos y por ese orden con 20 mL de cloruro de hierro (III) 2M, (fig.2),
agregándose en todos los casos agua destilada hasta completar 50mL
a)Formula las reacciones que tienen lugar en cada tubo.
b)Cuál será la concentración de ion ferroso en C (superior)
c)Cuál será la concentración de ion férrico en D (inferior),
En la pila de la figura, el electrodo A, es un papel de estaño , sumergida en una sal de Sn2+ 0,1M . Mientras que en B se dispone una lámina de cobre, en una disolución de sulfato de cobre(II). Se unen por un papel de filtro humedecido en una disolución de nitrato sódico. Conociendo los potenciales normales de reducción de los siguientes pares:
E0 del par Sn2+/Sn = -0,14V.
E0 del par Cu2+/Cu =0,36V.
Determina:
a) La reacción química que tiene lugar, señalando el ánodo y el cátodo de la pila
b) La concentración de la sal de cobre
c) La simbología de la pila

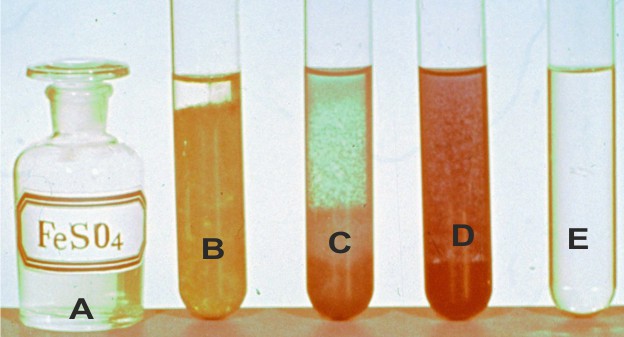
Fig.1

Fig.2