ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
sección: PRUEBAS DE QUÍMICA.ACCESO A ESTUDIOS UNIVERSITARIOS
|
|
CENTRO: Examen adaptado
a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Curso MATERIA: QUÍMICA |
Clave 2.1AN |
| INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
opciones, A y B, ambas con tres cuestiones y dos problemas. El alumno
deberá optar por una de las opciones sin que pueda elegir problemas y cuestiones
de cada opción. Cada cuestión o problema puntuará sobre un máximo de
dos puntos. No se contestará ninguna pregunta en este impreso. TIEMPO: una hora y treinta minutos |
| OPCIÓN A |
| Cuestión
1.- Le dicen que un electrón está en la órbita N, subnivel p. a) ¿Cómo serían las órbitas en las que podría estar?
b)
¿Cuáles serían los números cuánticos de todos los electrones que pueden
estar en él. Puntuación máxima por
apartado: 1P |
| Cuestión
2.- Si se mezclas 50cc de disolución de ácido ortofosfórico 1M, con 150cc de disolución 2N del mismo ácido y se obtiene una disolución de densidad 1,2g/ml a) ¿Cuál será su molaridad?
b)
¿Cuál será su molalidad, suponiendo los volúmenes aditivos?. DATOS: P,31-O,16-H,1 Puntuación máxima por
apartado: 1P |
| Cuestión
3.- El trabajo de extracción del electrón de un metal es de 2,3eV. a) Cuál es la frecuencia umbral para la luz que los convierta en fotoelectrones.
b)
Si se ilumina con fotones de 500nm, con qué velocidad saldrían de la placa metálica. DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg
1eV=1,6.10-19J. Puntuación máxima por apartado: 1P |
| Problema 1.- Se hace gotear 50ml de disolución de permanganato potásico al 20%, (densidad 1,4g/ml) sobre una disolución de hidróxido potásico, formándose manganato potásico, agua y desprendiéndose oxígeno. a) Ajuste la reacción por el método ion-electrón b) Determine el número de
moléculas de oxígeno obtenidas si
el rendimiento de la reacción es del 70% DATOS: Mn=53,5- O=16 - K=39 Puntuación máxima por
apartado: 1P |
| Problema 2.- En la serie de Brackett el electrón del H emite una radiación cuya L es 1,14.1014Hz a) ¿Desde qué órbita cayó? b) ¿Cuál era su energía cinética en dicha órbita ?
c)
¿En cuántas rayas se desdoblaría la raya del espectro según T. Sommerfeld?. DATOS: Me=9,1.10-31 kg
h=6,63.10-34J.s; c=3.108ms-1 Puntuación
máxima por apartado: a) 0,75P- b) 0,75P- c)0,5P |
| OPCIÓN B |
| Cuestión
1.- a) ¿Qué importancia tiene el Principio de Exclusión de Pauli? b) ¿Cuáles serían los números cuánticos de un electrónque estuviera en el nivel O, subnivel f? Puntuación
máxima por apartado: 1P |
| Cuestión
2.- La longitud de onda de De Broglie para el electrón excitado del hidrógeno es :1,33.10-9m, a) Determine la órbita en la que está y la cantidad de movimiento del electrón en la misma.
b)
¿Cuántos subniveles tendría? DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg c=3.108 ms-1 Puntuación máxima por apartado: 1P |
| Cuestión 3 El dióxido de carbono gaseoso se combina con el carbono sólido para
formar monóxido de carbono gas.
a)
Formule y ajuste la reacción.
b)
Si se hacen reaccionar 1,2.1023
moléculas de dióxido de carbono con 6 gramos de carbono en un recipiente de
2 litros. ¿Qué presión ejercerán a 27ºC , antes de reaccionar? .¿Y después?. DATOS: C=12, O=16. N.Avogadro= 6,0.1023
.mol-1, R=0,082 atm.L K-1 mol-1 Puntuación máxima por apartado: 1P |
| Problema 1.- Se hace gotear 50ml ácido sulfúrico 2M, sobre S sólido, produciéndose dióxido de azufre (gas) y agua. a) Ajústela por el método ion-electrón, indicando el oxidante y el reductor.
b)
Determine el volumen
de gas a producido en condiciones normales DATOS: volumen molar=22,4Lmol-1 Puntuación
máxima por apartado: 1P |
| Problema 2.- a) ¿Cuál el momento cinético de el electrón excitado del hidrógeno en la órbita P? b) ¿Cuál es el radio de dicha órbita?
c)
¿Cuánto vale su energía potencial? DATOS: Me=9,1.10-31 kg h=6,63.10-34J.s; c=3.108m/s Puntuación
máxima por apartado: a) 0,75P- b) 0,75P- c)0,5P |
|
|
CENTRO: Examen adaptado
a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Curso MATERIA: QUÍMICA |
2.1BN |
| INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
opciones, A y B, ambas con tres cuestiones y dos problemas. El alumno
deberá optar por una de las opciones , sin que pueda elegir problemas
y cuestiones de cada opción. Cada cuestión o problema puntuará sobre
un máximo de dos puntos. No se contestará ninguna pregunta en este
impreso. TIEMPO: una hora y treinta minutos |
| OPCIÓN A |
| Cuestión
1.- Le dicen que un electrón está en la órbita M, subnivel p. a) ¿Cómo serían la órbitas en las que podría estar?
b)
¿Cuáles serían los números cuánticos de todos los electrones que pueden
estar con él? Puntuación máxima por
apartado: 1P |
| Cuestión
2.- Si se mezcla 50cc de disolución de ácido sulfúrico 1M, con 150cc de disolución 4N del mismo ácido y se obtiene una disolución de densidad 1,5g/ml , suponiendo los volúmenes aditivos: a) ¿Cuál será su molaridad?
b)
¿Cuál será su molalidad?. Puntuación máxima por
apartado: 1P |
| Cuestión
3.- El trabajo de extracción del electrón de un metal es de 2,9eV. a) Cuál es la frecuencia umbral para la luz que los convierta en fotoelectrones.
b)
Si se ilumina con fotones de 500nm, con qué velocidad saldrían de la placa metálica. DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg
1eV=1,6.10-19J. Puntuación máxima por apartado: 1P |
| Problema 1.- Se hace gotear 50ml de disolución de clorato potásico al 20%, (densidad 1,1g/ml) sobre una disolución de cloruro de cobalto(II), en medio básico (hidróxido potásico) formándose óxido de cobalto(III), cloruro potásico y agua a) Ajuste la reacción por el método ion-electrón
b)
Determine el número de moléculas de cloruro potásico obtenidas
si el rendimiento de la reacción es del 70% DATOS: Cl=35,5- O=16, K=39 Puntuación máxima por
apartado: 1P |
| Problema 2.- En la serie de Paschen el electrón del H emite una radiación cuya 8 es 1,1.10-6m a) ¿Desde qué órbita cayó? b) ¿Cuál era su energía cinética en dicha órbita ?
c)
¿En cuántas rayas se desdoblaría la raya del espectro según T. Sommerfeld?. DATOS: Me=9,1.10-31 kg h=6,63.10-34J.s; c=3.108ms-1 Puntuación
máxima por apartado: a) 0,75P- b) 0,75P- c)0,5P |
| OPCIÓN B |
| Cuestión
1.- Se dan 3 disposiciones de los números cuánticos n,l y m que determinan un electrón: (3,2,½), (3,3,3),(3,2,0): a) ¿Cuáles no son posibles? Justifíquelo.
b)
¿Cómo sería la órbita que describiría dicho electrón? Dibújela aproximadamente. Puntuación
máxima por apartado: 1P |
| Cuestión
2.- La longitud de onda de De Broglie para un electrón excitado del hidrógeno es :1,66.10-9m, a) Determine la órbita en la que está y la cantidad de movimiento del electrón en la misma.
b)
¿Cuántos subniveles tendría? DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg c=3.108 ms-1 Puntuación máxima por apartado: 1P |
| Cuestión 3 El dióxido de azufre gaseoso se combina con oxígeno para formar trióxido
de azufre
a)
Formule y ajuste la reacción.
b)
Si se hacen reaccionar 1,2.1023
moléculas de dióxido de carbono con 8 gramos de oxígeno en un recipiente de
2 litros. ¿Qué presión ejercerán a 27ºC antes de reaccionar? ¿Y después? DATOS: S=32, O=16. N.Avogadro= 6,0.1023
.mol-1, R=0,082 atm.L K-1 mol-1 Puntuación máxima por apartado: 1P |
| Problema 1.- La reacción entre dos disoluciones de permanganato
potásico y de ácido clorhídrico,
producen cloru-ro de manganeso (II), cloro (gas), cloruro potásico y
agua. a) Ajústela por el método ion-electrón, indicando el oxidante y el reductor
b)
Determine el volumen de cloro obtenido en condiciones normales si se
gasta completamente 100ml de disolución de ácido clorhídrico 2N. Puntuación
máxima por apartado: 1P |
| Problema 2.- a) ¿Cuál es el momento cinético del electrón excitado del hidrógeno hasta la órbita O? b) ¿Cuál es el radio de dicha órbita?
c)
¿Cuánto vale en O, su energía potencial? DATOS: Me=9,1.10-31 kg h=6,63.10-34J.s; c=3.108m/s Puntuación
máxima por apartado: a) 0,75P- b) 0,75P- c)0,5P |
|
|
CENTRO: Examen adaptado
a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Curso MATERIA: QUÍMICA |
CLAVE 2.2AN |
| INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
opciones, A y B, ambas con tres cuestiones y dos problemas. El alumno
deberá optar por una de las opciones
sin que pueda elegir problemas
y cuestiones de cada opción. Cada cuestión o problema puntuará sobre
un máximo de dos puntos. No se contestará ninguna pregunta en este
impreso. TIEMPO: una hora y treinta minutos |
| OPCIÓN A |
| Cuestión
1.- Le dan 3 disposiciones de los números cuánticos n,l y m que determinan un electrón: (4,2,-½), (4,4,3),(4,2,0). a) ¿Cuáles no son posibles? b) ¿Cuántos electrones le acompañarían en el subnivel? c) ¿Cómo sería la órbita que describiría este electrón? d) Compárela con el orbital indicado por esos números
cuánticos Puntuación máxima por
apartado: 0,5P |
| Cuestión
2.- Si se mezclan 50cc de disolución de ácido sulfúrico 1M, con 150ml de otra 1m del mismo ácido y con densidad 1,5g/ml. Suponiendo los volúmenes aditivos a) ¿Cuál será la molaridad de la disolución resultante?
b)
¿Cuál será su normalidad? DATOS: Masa molar del ácido sulfúrico=98g/mol Puntuación máxima por
apartado: 1P |
| Cuestión
3.- a)¿Cómo se averiguó la relación carga/masa del electrón? b)¿Por qué fue importante? Puntuación máxima por apartado: 1P
|
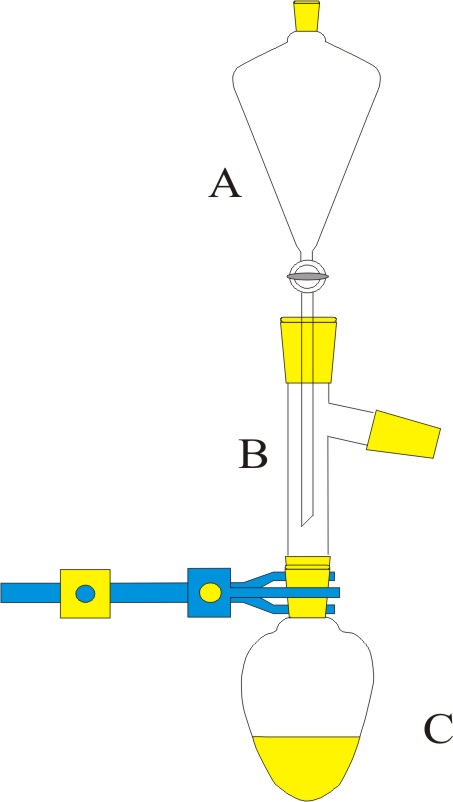
| Problema 1.- Disponiendo
del montaje de la figura, se hacen gotear 50ml de disolución de nitrato
potásico al 20%, (densidad 1,1g/ml) en A, sobre una disolución con cantidad suficiente de dióxido de manganeso
e hidróxido potásico en B, formándose
manganato potásico, nitrito potásico y agua. a) Ajuste la reacción por el método ión-electrón b) Determine el número de moléculas de nitrito
potásico obtenidas si el rendimiento de la reacción es del 70%. c) Indique los nombres del material de laboratorio
empleado DATOS: N= 6,022.1023 moléculas.mol-1.
N=14, O=16, K=39 Puntuación máxima por apartado: 0,75 a- 0,75 b – 0,5 P |
| Problema 2.- a) Determine la máxima longitud de onda correspondiente a la radiación emitida por el electrón en la serie de Brackett. b) ¿Cuál sería la velocidad del electrón en la órbita inicial?
c)
¿En cuántas rayas se desdoblaría la raya del espectro según T. Sommerfeld? DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg c=3.108 ms-1 Puntuación
máxima por apartado: a) 0,75P- b) 0,75P- c)0,5P |
| OPCIÓN B |
| Cuestión
1.-
a)
¿Qué significado tiene el número cuántico magnético?
b)
¿Y el de spin? ¿En qué unidades se miden? Puntuación
máxima por apartado: 1P |
| Cuestión
2.- Si la energía cinética de un electrón es 0,848eV, determine la longitud de onda de De Broglie. a) ¿En qué nivel estaba el electrón?
b)
¿Cuál sería el radio de dicha órbita? DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg
1eV=1,6.10-19J. Puntuación máxima por apartado: 1P |
| Cuestión 3 Si en un recipiente se introducen 1,8.1023 moléculas de hidrógeno, y se hacen reaccionar completa-mente con 14g de nitrógeno. a) ¿Qué se obtiene? Formule la reacción.¿Sobra algo?
b)
El gas resultante se hace pasar sobre 1 litro de agua. ¿Cuál sería la
molalidad de la disolución formada.
c)
El producto resultante reacciona con una disolución 1N de ácido clorhídrico
¿Qué volumen de ella sería necesaria?
Formule las reacciones. DATOS: N=14, H=1. N.Avogadro= 6,0.1023
.mol-1 Puntuación
máxima por apartado: 0,75 a- 0,75 b – 0,5 c |
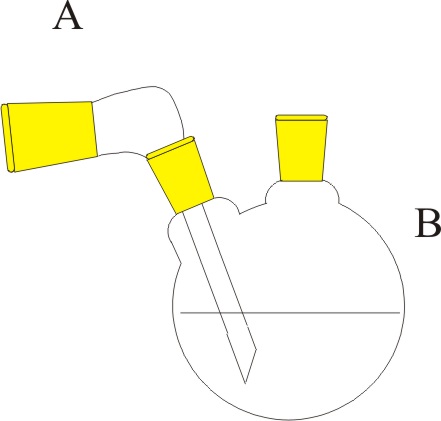
| Problema 1.- Disponiendo
del montaje de la figura, se hace reaccionar dicromato potásico en exceso
en Cy una disolución de ácido clorhídrico en A, produciéndose cloruro
de cromo(III), cloro(gas), cloruro potásico y agua. a) Ajuste la reacción por el método ión-electrón. b) Determine el número de moléculas de cloro obtenidas si se gasta completamente 100mL de disolución
de ácido clorhídrico 2N. c) Indique los nombres del material de laboratorio empleado. DATOS:
N= 6,022.1023 moléculas.mol-1 Puntuación
máxima por apartado: 0,75 a- 0,75 b – 0,5 c |
| Problema 2.- a) Determinar la energía, y la frecuencia de la radiación luminosa que haría falta para ionizar al electrón excitado del hidrógeno en la órbita N.
b)
¿Cuál sería la velocidad y momento cinético del electrón en dicha órbita? DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg c=3.108 ms-1 Puntuación
máxima por apartado: 1P |
|
|
CENTRO: Examen adaptado
a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) MATERIA: QUÍMICA |
2.2BN |
| INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
opciones, A y B, ambas con tres cuestiones y dos problemas. El alumno
deberá optar por una de las opciones, sin que pueda elegir problemas
y cuestiones de cada opción. Cada cuestión o problema puntuará sobre
un máximo de dos puntos. No se contestará ninguna pregunta en este
impreso. TIEMPO: una hora y treinta minutos |
| OPCIÓN A |
| Cuestión
1.- Le dan 3 disposiciones de los números cuánticos n,l y m que determinan un electrón: (3,2,-½), (3,3,3),(3,2,0). a) ¿Cuáles no son posibles? b) ¿Cuántos electrones le acompañarían en el subnivel? c) ¿Cómo sería la órbita que describiría este electrón? d) Compárela con el orbital indicado por esos números
cuánticos. Puntuación máxima por
apartado: 0,5P |
| Cuestión
2.- Si se mezclan 50cc de disolución de ácido clorhídrico 1M, con 150ml de otra 4m del mismo ácido y con densidad 1,1g/ml. Suponiendo los volúmenes aditivos a) ¿Cuál será la molaridad de la disolución resultante?
b)
¿Cuál será su normalidad? DATOS: Masa molar del ácido clorhídrico=36,5g/mol. Puntuación máxima por
apartado: 1P |
| Cuestión
3.- a) ¿Qué dice el segundo postulado de Bohr? b) ¿En qué se ha basado? Puntuación máxima por apartado: 1P |
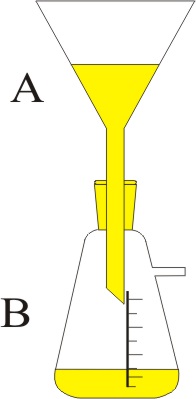
Disponiendo del montaje de la figura, se hace burbujear 100cm3 de disolución de cloro gas en condiciones normales sobre una disolución que contiene yodato potásico e hidróxido potásico en B, obteniéndose peryodato potásico, cloruro potásico y agua. a) Ajuste la reacción por el método ión-electrón. b) Determine el número de moléculas
de cloruro potásico obtenidas si
el rendimiento de la reacción
es del 70%. c) Indique los nombres del material de laboratorio
empleado. DATOS: N= 6,022.1023 moléculas.mol-1.
N=14, O=16, K=39 Puntuación
máxima por apartado: 0,75 a-
0,75 b – 0,5 c |
| Problema 2.- a) Determine la máxima longitud de onda correspondiente a la radiación emitida por el electrón en la serie de Paschen b) ¿Cuál sería la velocidad del electrón en la órbita inicial?
c)
¿En cuántas rayas se desdoblaría la raya del espectro según T. Sommerfeld? DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg c=3.108 ms-1 Puntuación
máxima por apartado: a) 0,75P- b) 0,75P- c)0,5P |
| OPCIÓN B |
| Cuestión
1.-
a)
¿Qué es el efecto fotoeléctrico? b) ¿Qué importancia tiene? Puntuación
máxima por apartado: 1P |
| Cuestión
2.- Si la energía cinética de un electrón es 1,54eV: a) ¿En qué nivel estaba el electrón?
b)
¿Cuál sería el radio de dicha órbita? DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg
1eV=1,6.10-19J. Puntuación máxima por apartado: 1P |
| Cuestión 3.- Si en un recipiente se introducen 1,2.1024 moléculas de cloro, y se hacen reaccionar completamente con 10g de hidrógeno. a) ¿Qué se obtiene? Formule la reacción.¿Sobra algo?
b)
El gas resultante se hace pasar sobre 1 litro de agua. ¿Cuál sería la
molaridad de la disolución formada.
c)
El producto resultante reacciona con una disolución 1N de ácido clorhídrico
¿Qué volumen de ella sería necesaria?
Formule las nuevas reacciones. DATOS: Cl=35,5, H=1. N= 6,0.1023
moléculas.mol-1 Puntuación
máxima por apartado: 0,5 a- 0,75
b – 0,75 c |
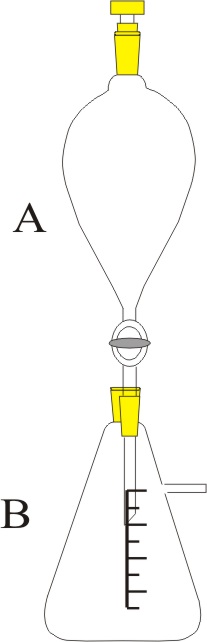
| Problema 1.- Disponiendo
del montaje de la figura, se hace reaccionar dicromato potásico en exceso
y una disolución de ácido sulfhídrico en medio sulfúrico, produciéndose
sulfato de cromo(III), azufre sólido, sulfato potásico y agua. a) Ajuste la reacción por el método ión-electrón. b) Determine el número de átomos
de azufre de cloro obtenidas si
se gasta completamente 100mL de disolución de ácido sulfhídrico 2N. c) Indique los nombres del material de laboratorio empleado. DATOS:
N= 6,022.1023.mol-1. Puntuación
máxima por apartado: 0,75 a-
0,75 b – 0,5 c |
| Problema 2.- a) Determinar la energía, y la frecuencia de la radiación luminosa que haría falta para ionizar al electrón excitado del hidrógeno en la órbita P.
b)
¿Cuál sería la velocidad y momento cinético del electrón en dicha órbita? DATOS: h=6,63.10-34 J.s. Me=9,1.10-31 kg c=3.108 ms-1 Puntuación
máxima por apartado: 1P |