ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
|
|
CENTRO: Examen adaptado a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Curso MATERIA: QUÍMICA |
5.1AN |
| INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
opciones, A y B, ambas con tres cuestiones y dos problemas. el alumno
deberá optar por una de las opciones, sin que pueda elegir problemas
y cuestiones de cada opción. Cada cuestión o problema puntuará sobre
un máximo de dos puntos. No se contestará ninguna pregunta en este
impreso. TIEMPO: una hora y treinta minutos |
| OPCIÓN A |
| Cuestión
1.- La
entalpía de formación estándar del octano( líquido) vale -250kJ/mol,
si las de formación del CO2(g) y del H2O(L) valen
respectivamente -392 y -286 kJ/mol. Determine:
a)
El calor de combustión del octano
b)
La variación de energía interna en
el proceso en condiciones estándar DATOS: R=8,31
JK-1.mol-1 Puntuación máxima por
apartado: 1 P |
| Cuestión
2.-
a)
¿Qué dice la ley de Hess?.
b)
¿Para qué se emplea? Ponga un ejemplo. Puntuación máxima por
apartado: 1P |
| Cuestión
3.- Se dispone de una reacción A(g)+ B(g) ! C(g), y se sabe que si duplicas la concentración de A sin variar B,
la velocidad se hace doble, pero si duplicas la concentración B sin
modificar A, la velocidad se hace cuádruple.
a)
Formule la expresión de la velocidad
de reacción
b)
¿Cuál sería el orden
parcial y total de la misma? Puntuación máxima por apartado: 1P |
| Problema 1.- Un calorímetro con capacidad calorífica de 0,7 kJ/K, contiene 0,700kg de agua. En su interior hay 4,4g de etanal en exceso de oxígeno. Se provoca la ignición eléctricamente formándose por combustión completa dióxido de carbono gas y agua líquida. Si la temperatura aumenta en 33ºC: a) Formule la reacción de combustión y calcula el )H0C para el propanal(L) en kJ/mol. b) Si las entalpías de formación del CO2(g) y del agua líquida son respectivamente -393,5 y -285,8 kJ/mol , determine la entalpía de formación del propanal. DATOS: C=12, O=16, H=1. Calor específico del agua=4,17 kJ /kg ºC Puntuación máxima por
apartado: 1P |
| Problema 2.- En una vasija de 2 litros se introducen 2 moles
de pentacloruro de fósforo(g) y se cierra herméticamente. Se calienta
hasta 500K, aumentando la presión debido a la disociación térmica, en
tricloruro de fósforo y cloro, hasta alcanzar en el equilibrio 50 atm.
a)
Calcule el grado de disociación del
pentacloruro de fósforo
b)
Determine Kp.
c)
Si la presión se reduce
a la mitad , ¿variaría el grado de disociación? En caso positivo ¿cuánto
valdría? DATOS: R=0,082 atm.L K-1 mol-1 Puntuación
máxima por apartado: a) 0,75P- b) 0,75P- c)0,5P |
| OPCIÓN
B |
| Cuestión 1.-
a) Cómo variaría la entropía en la transformación: metanol(líquido) + amoniaco(gas) = metilamina(gas) + agua(gas).
b)
Si la reacción es endotérmica, ¿será espotánea?. Justifique. Puntuación máxima
por apartado: 1P |
|
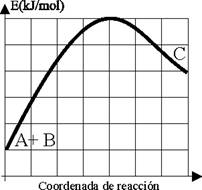
Cuestión 2.- Dada la reacción entre A+B ö C(g),a 1000K
cuya variación energética viene dada por la gráfica adjunta en kJ/mol
(cada cuadrado 2 unidades en el S.I). Indique:
a) Si la reacción es exergónica o
endergónica b) Si la reacción es exotérmica o
endotérmica, indicando la energía en cada caso c) La energía de activación
necesaria para que se efectúe d)
La fracción del nº de moléculas que la posee DATOS:
R=8,31 JK-1.mol-1 Puntuación
máxima por apartado: 0,5 P |
| Cuestión 3 En
el equilibrio químico: MgCO3
(s)» MgO(s) + CO2(g), )H>0. En qué
sentido se desplazaría si: a)
Aumenta la presión. b) Se enfría. Cómo
variaría Kp si :a) Aumenta el volumen .b) Disminuye la temperatura Puntuación máxima
por apartado: 0,5P |
| Problema 1.- En
el proceso en equilibrio A(g)+ 2B(g)øC(g), a 700K,
en un recipiente de 10L, la concentraciones iniciales de A y B fueron
respectivamente 0,05 y 0,03 moles/L, y en el equilibrio se encontró
que el número de moles de B era exactamente igual al de C.
a)
Determine las concentraciones en
el equilibrio
b)
Calcule Kc y Kp DATOS: R=0,082
atm.L K-1 mol-1 Puntuación máxima
por apartado: 1P |
| Problema 2.- Conociendo
las entalpías de formación de SO2 y SO3 ( -296,06
y -395,18 kJ/mol respectivamente)y las entropías respectivas de ambos
y del oxígeno:(248,52; 256,22 y 205,03 J/K.mol), para la reacción en
fase gaseosa SO3 º SO2+ ½O2 a) ¿Cuál es la variación de energía
libre en dicho proceso? b) ¿Cuál la temperatura de equilibrio?.
c) ¿Cuál la constante de equilibrio
a esa temperatura? Supóngase que )H y )S son constantes con la Tª. DATOS: R=
8,31 JK-1.mol-1 Puntuación máxima
por apartado: a) 0,5P- b) 0,75P- c)0,75P |

|
|
CENTRO: Examen adaptado
a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Curso MATERIA: QUÍMICA |
Clave 5.1BN |
| INSTRUCCIONES
GENERALES Y VALORACIÓN La prueba consta de dos opciones, A y B, ambas
con tres cuestiones y dos problemas. el alumno deberá optar por una
de las opciones, sin que pueda elegir problemas y cuestiones de
cada opción. Cada cuestión o problema puntuará sobre un máximo de dos
puntos. No se contestará ninguna pregunta en este impreso. TIEMPO:
una hora y treinta minutos |
| OPCIÓN
A |
| Cuestión 1.-
La
entalpía de formación estándar del hexano(líquido) vale -198kJ/mol,
si las de formación del CO2(g) y del H2O(L) valen
respectivamente -392 y -286 kJ/mol. Determine:
a)
El calor de combustión del octano
b)
La variación de energía interna en el proceso
en condiciones estándar DATOS: R=8,31 JK-1.mol-1 Puntuación máxima por
apartado: 1P |
| Cuestión 2.-
a)
¿Cómo influye un catalizador en un
equilibrio químico
b)
¿Y en la velocidad de reacción? Puntuación máxima por
apartado: 1P |
| Cuestión 3.- Se dispone de una reacción A(g)+ B(g) ! C(g), y se sabe que si duplicas la concentración de A sin variar B,
la velocidad se hace 8 veces mayor, pero si duplicas la concentración
B sin modificar A, la velocidad se hace cuádruple.
a)
¿Cuál sería el orden
parcial y total de la misma?
b)
Formule la expresión de la velocidad
de reacción
c)
Puntuación máxima por apartado: 1P |
| Problema 1.- Conociendo
las entalpías de formación de CO2 y CO ( -394 y -111 kJ/mol
respectivamente)y las entropías respectivas de ambos y del oxígeno:(214;
198 y 205 J/K.mol), para la reacción en fase gaseosa 2CO+
O2 º2CO2 a) ¿Cuál es la variación de energía
libre en dicho proceso?. b) ¿Cuál la temperatura de equilibrio?.
c) ¿Cuál la constante de equilibrio
a esa temperatura?. Supóngase que )H y )S son constantes con la Tª. DATOS: R= 8,31
JK-1.mol-1 Puntuación máxima
por apartado: a) 0,75P- b) 0,5P – c) 0,75P |
| Problema 2.- En el proceso en equilibrio 2A(g)+ 3B(g)ø 2C(g), a 500K, en un recipiente de 10L, la concentraciones iniciales
de A y B fueron respectivamente 0,2 y 0,1 moles/L, y en el equilibrio
se encontró que el número de moles de C era exactamente el triple de B.
a)
Determine las concentraciones en
el equilibrio
b)
Calcule Kc y Kp DATOS: R=0,082
atm.L K-1 mol-1 Puntuación máxima
por apartado: 1P |
| OPCIÓN
B |
| Cuestión 1.-
a) ¿Qué es la entropía? b) ¿Cómo se evalúa? c) ¿Qué papel desempeña en una reacción química?
d)
Compare la entropía de un mol de agua en el estado sólido, líquido y
gas. Puntuación máxima por
apartado: 0,5 P |
|
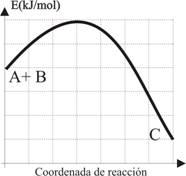
Cuestión 2.- Dada la reacción entre A+B ö C(g),a 500K
cuya variación energética viene dada por la gráfica adjunta en kJ/mol
(cada cuadrado 2 unidades en el S.I). Indique:
a) Si La reacción es exergónica o
endergónica b) Si la reacción es exotérmica o
endotérmica, indicando la energía en cada caso c) La energía de activación
necesaria para que se efectúe d)
La fracción del nº de moléculas que la posee DATOS: R= 8,31 JK-1.mol-1 Puntuación máxima por apartado: 0,5 P |
| Cuestión 3 En
el equilibrio químico: BaCO3
(s)» BaO(s) + CO2(g), )H>0. En qué
sentido se desplazaría si: a)
Aumenta la presión. b) Se enfría. Cómo
variaría Kp si :a) Aumenta el volumen .b) Disminuye la temperatura Puntuación máxima
por apartado: 0,5P |
| Problema 1.- En una vasija de 10 litros se introducen 4 moles de pentacloruro de fósforo(g)
y se cierra herméticamente. Se calienta hasta 500K, aumentando la presión
debido a la disociación térmica, en tricloruro de fósforo y cloro, hasta
alcanzar en el equilibrio 20 atm.
a)
Calcule el grado de disociación del
pentacloruro de fósforo
b)
Determine Kp.
c)
Si la presión se duplica
¿variaría el grado de disociación?. En caso positivo ¿cuánto
valdría?. DATOS: R=0,082 atm.L K-1 mol-1 Puntuación máxima
por apartado: a) 0,75P- b) 0,75P – c) 0,5P |
| Problema 2.- Un calorímetro con capacidad calorífica de 0,7 kJ/K, contiene 0,700kg de agua. En su interior hay 2,7g de propanol en exceso de oxígeno. Se provoca la ignición eléctricamente formándose por combustión completa dióxido de carbono gas y agua líquida. Si la temperatura aumenta en 25ºC, a) Formule la reacción de combustión y calcula el )H0C para el propanol(L) en kJ/mol. b) Si las entalpías de formación del CO2(g) y del agua líquida son respectivamente: -393,5 y -285,8 kJ/mol , determine la entalpía de formación del propanol. DATOS: C=12, O=16, H=1. Calor específico del
agua=4,17 kJ /kg ºC Puntuación máxima
por apartado: 1P |
|
|
CENTRO: Examen adaptado
a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Curso MATERIA: QUÍMICA |
5.2AN |
| INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
opciones, A y B, ambas con tres cuestiones y dos problemas. el alumno
deberá optar por una de las opciones, sin que pueda elegir problemas
y cuestiones de cada opción. Cada cuestión o problema puntuará sobre
un máximo de dos puntos. No se contestará ninguna pregunta en este
impreso. TIEMPO: una hora y treinta minutos |
||||||||||||||||||
| OPCIÓN A |
||||||||||||||||||
| Cuestión
1.- Dado
el sistema en un equilibrio:
A(s)» B(s) + C(g),
)H>0
a)
¿Cuáles son sus características?
b)
¿Cuándo podrá ser nula la variación
de su energía interna? DATOS: R=8,31 JK-1.mol-1 Puntuación máxima por apartado: 1P |
||||||||||||||||||
| Cuestión
2.- Razone en qué situaciones podrían ser espontáneos los procesos cuyas variaciones correspondientes a sus términos entálpicos o entrópicos son las siguientes: a) )H>0, )S>0 . b) )H<0 , )S<0
. c) )H<0,
)S>0
. d) )H>0
, )S<0. Puntuación máxima por
apartado: 0,5 P |
||||||||||||||||||
|
[A] mol/L [B] mol/L v ( mol(L.min) 1 0,1 0,06 0,4 2 0,2 0,06 3,2 3 0,1 0,12 1,6 Se dispone de una reacción A(g)+
B(g) ! C(g), de la que se dan los datos incluidos
en la tabla adjunta. Determine:
a)
el orden de la reacción
b)
su velocidad específica, indicando sus unidades Puntuación máxima por apartado: 1 P |
||||||||||||||||||
| Problema 1.- Sabiendo que el calor de formación del carbonato cálcico es -1202 kJ/mol y que: Ca(s)+ ½O2(g) = CaO(s) H0=-633kJ/mol y C(s)+O2(g)=CO2(g)
H0 = -392kJ/mol a) Formule la reacción termoquímica de formación del carbonato de calcio(s).
b)
Calcule el calor desprendido cuando fragua 1 kg de cal según la reacción:
CaO(s) + CO2(g) = CaCO3(s) DATOS: C=40, O=16, C=12 Puntuación máxima por
apartado: 1P |
||||||||||||||||||
| Problema 2.- En una vasija de 10 litros se introducen 8
moles de tetraóxido de dinitrógeno(g) y se cierra herméticamente.
Se calienta hasta 500K, aumentando la presión debido a la disociación
térmica, en dióxido de nitrógeno, hasta alcanzar en el equilibrio 50
atm. a) Calcule el grado de disociación del tetraóxido
b) Determine Kp. c) Si se duplica la presión, ¿variaría el grado
de disociación? ¿cuánto valdría?. DATOS: R=0,082 atm.L K-1
mol-1 Puntuación
máxima por apartado: a) 0,75P- b) 0,75P- c)0,5P |
| OPCIÓN
B |
||
| Cuestión 1.-
En la reacción exotérmica dada, en el sentido indicado, A(s)+ B(L) !2C(g) responde razonadamente si: a) La variación de energía libre es positiva b) La variación de entropía es positiva c) La variación de entalpía es negativa
d)
La variación de energía interna es positiva Puntuación máxima
por apartado: 0,5P |
||
| Cuestión 2.-
a) Si la reacción es exergónica o
endergónica b) Si la reacción es exotérmica o
endotérmica, indicando la energía en cada caso c) La energía de activación
necesaria para que se efectúe d)
La fracción del nº de moléculas que la posee DATOS: R=
8,31 JK-1.mol-1 Puntuación máxima
por apartado: 0,5 P |
||
| Cuestión 3 Contesta razonadamente: a)
En qué casos Kp > Kc b)
En que casos Kp=Kc c) ¿Puede depender Kp de una sola sustancia? d) ¿Y Kc? Puntuación máxima
por apartado: 0,5 P |
||
| Problema 1.- Conociendo las entalpías estándar de formación de HBr(g) ,Br2
(g) y H2O(g) ( -36,3, 30,9 y -242 kJ/mol)y las entropías
respectivas y del oxígeno:(198,7; 246 , 189 y 205,2 J/K.mol). Para la reacción en fase gaseosa :
4HBr(g)+ O2 (g)º 2Br2 (g)+ 2H2O(g)
a)
¿Cuál es la variación de energía
libre en dicho proceso?
b)
¿Cuál la temperatura de equilibrio?
c)
¿Cuál la constante de equilibrio a esa temperatura?
DATOS: R= 8,31
JK-1.mol-1 Puntuación máxima
por apartado: a) 0,75P- b) 0,5P – c) 0,75P |
||
| Problema 2.- En
el proceso en equilibrio A(g)+ B(g) X2C(g), a 500K, en un recipiente de
10L, moles iniciales de A y B
fueron respectivamente 3 y 1 moles y en el equilibrio se encontró que
el número de moles de C es la mitad que de B.
a)
Determine las concentraciones en
el equilibrio,
b)
Calcule Kc y Kp DATOS: R=0,082
atm.L K-1 mol-1 Puntuación máxima
por apartado: 1P |
|
|
CENTRO: Examen adaptado a la PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOE) Curso MATERIA: QUÍMICA |
5.2BN |
| INSTRUCCIONES
GENERALES Y VALORACIÓN La prueba consta de dos opciones, A y B, ambas
con tres cuestiones y dos problemas. el alumno deberá optar por una
de las opciones, sin que pueda elegir problemas y cuestiones de
cada opción. Cada cuestión o problema puntuará sobre un máximo de dos
puntos. No se contestará ninguna pregunta en este impreso. TIEMPO:
una hora y treinta minutos |
||||||||||||||||||
| OPCIÓN
A |
||||||||||||||||||
| Cuestión 1.-
Dado
el sistema en un equilibrio:
2A(g)» 2B(g) + C(g),
)H<0
a)
¿Cuáles son sus características?
b)
¿Cuándo podrá ser nula la variación
de su energía interna? DATOS: R=8,31 JK-1.mol-1 Puntuación máxima por
apartado: 1P |
||||||||||||||||||
| Cuestión 2.-
En la reacción endotérmica dada, en el sentido indicado, A(s)+ B(g) !2C(g) responde razonadamente si: a) La variación de energía libre es positiva b) La variación de entropía es positiva c) La variación de entalpía es negativa
d)
La variación de energía interna es positiva Puntuación máxima
por apartado: 0,5P |
||||||||||||||||||
|
[A] mol/L [B] mol/L v ( mol(L.min) 1 0,1 0,03 0,2 2 0,2 0,03 0,8 3 0,1 0,12 1,6 Se dispone de una reacción A(g)+
B(g) ! C(g), de la que se dan los datos incluidos
en la tabla adjunta. Determine:
a)
El orden de la reacción
b)
Su velocidad específica, indicando sus unidades Puntuación máxima por apartado: 1 P |
||||||||||||||||||
| Problema 1.- Conociendo
las entalpías de formación de HCl(g) y H2O(g) ( -92 y -242
kJ/mol)y las entropías respectivas y del oxígeno y cloro:(187; 246 ;
189; 205 y 223J/K.mol) Para
la reacción en fase gaseosa :4HCl(g)+ O2 (g)º 2Cl2 (g)+ 2H2O(g)
a)
¿Cuál es la variación de energía
libre en dicho proceso?
b)
¿Cuál la temperatura de equilibrio?
c)
¿Cuál la constante de equilibrio
a esa temperatura? DATOS: R= 8,31
JK-1.mol-1 Puntuación máxima
por apartado: a) 0,75P- b) 0,5P – c) 0,75P |
||||||||||||||||||
| Problema 2.- En
el proceso en equilibrio A(g)+ 2B(g) XC(g), a 500K, en un recipiente de 10L, moles
iniciales de A y B fueron respectivamente 2 y 1 moles y en el
equilibrio se encontró que el número de moles de C es
el doble que de B.
a)
Determine las concentraciones en
el equilibrio,
b)
Calcule Kc y Kp DATOS: R=0,082 atm.L K-1 mol-1. Puntuación máxima por apartado: 1P |
| OPCIÓN B |
| Cuestión
1.- En la reacción A=B se determina que a T y P ctes., la reacción es espontánea y endotérmica. Decir si es cierto o falso que de ello se deduce : a) Puesto que el proceso es endotérmico, la reacción no puede ser espontánea. b) La entalpía de formación de A es más positiva que la de B. c) B tiene una estructura más ordenada que A. d) B
tiene una estructura menos ordenada que A Puntuación
máxima por apartado: 0,5 PPuntuación máxima por apartado: 1P |
| Cuestión
2.- Dada la reacción entre A+B ö C(g),a 500K cuya variación energética viene dada por la gráfica adjunta
en kJ/mol (cada cuadrado 2 unidades en el S.I). Indique. a) Si la reacción es exergónica o
endergónica b) Si la reacción es exotérmica o
endotérmica, indicando la energía en cada caso c)
La energía de activación necesaria para que se efectúe d)
La fracción del nº de moléculas que la posee DATOS: R= 8,31 JK-1.mol-1 Puntuación máxima por
apartado: 0,5 P |
| Cuestión 3 Conteste razonadamente: a)
En qué casos Kp < Kc b)
En que casos Kc=Kp c) ¿Puede depender Kc de una sola sustancia? d) ¿Y Kp? Puntuación máxima por apartado: 0,5 P |
| Problema 1.- En una vasija de 10 litros se introducen 5 moles de tetraóxido de dinitrógeno(g)
y se cierra herméticamente. Se calienta hasta 700K, aumentando la presión
debido a la disociación térmica, en dióxido de nitrógeno, hasta alcanzar
en el equilibrio 30 atm. a) Calcule el grado
de disociación del tetraóxido b) Determine Kp. c) Si se duplica la
presión, ¿variaría el grado de disociación? ¿cuánto valdría?. DATOS: R=0,082 atm.L K-1
mol-1 Puntuación
máxima por apartado: a) 0,75P- b) 0,75P – c) 0,5P |
| Problema 2.- Sabiendo que la formación
del carburo cálcico sólido se desprenden 62,5 kJ y que la formación
del dióxido de carbono gas, desprende 392kJ, a parte de la reacción
: CaC2(s) + 2,5 O2 (g)
a) Formule la reacción de formación del carbonato cálcico sólido b) Determine su calor de formación Puntuación
máxima por apartado: 1P |