 Fig.1
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
PRECIPITACIÓN DE SALES DE Ag1+
22. Nitrato de plata y cloruro sódico.
Partimos de 2 gotas de nitrato de plata y cloruro sódico disuelto en agua (fig.1). Las unimos (fig.2). Rápidamente se produce un precipitado blanquecino de AgCl(Kps=1.10-10), que se extiende a las dos gotas (fig.3-5). Después al agregarle hidróxido amónico el precipitado se solubiliza. (fig.6-8) Los residuos se ennegrecen al formarse óxido de plata (fig.9-10)
 Fig.1
Fig.1
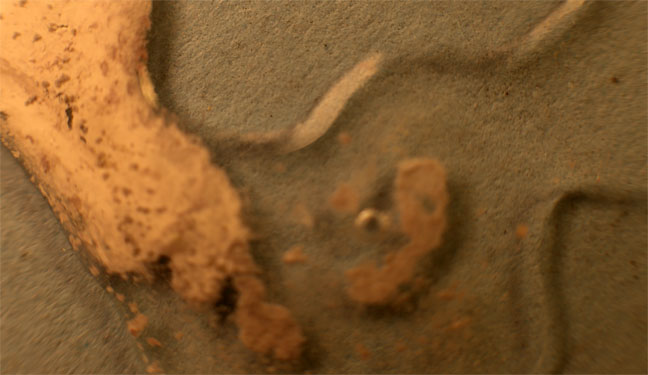
Fig.7

Fig.6
El proceso que tiene lugar es:
AgNO3 (ac)+ NaCl (ac)=
AgCl(s)+ 2NaNO3
Precipitado blanco
El proceso que tiene lugar es:
2NH3 (ac)+ AgCl(s)= [Ag(NH3)2]Cl (ac)

Fig.5
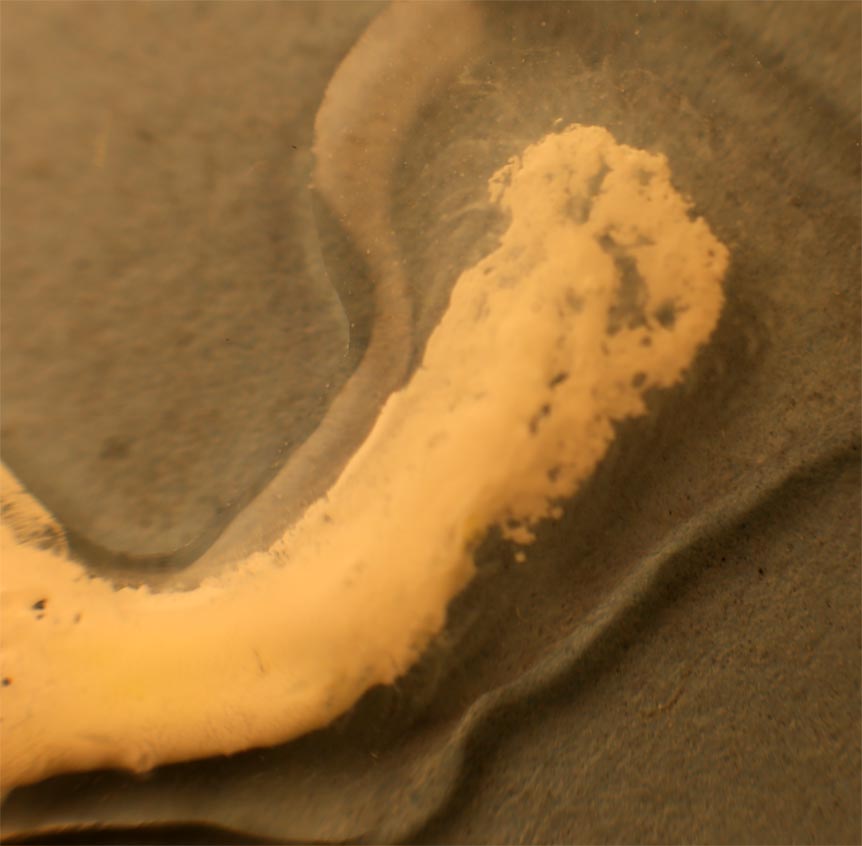
Fig.3
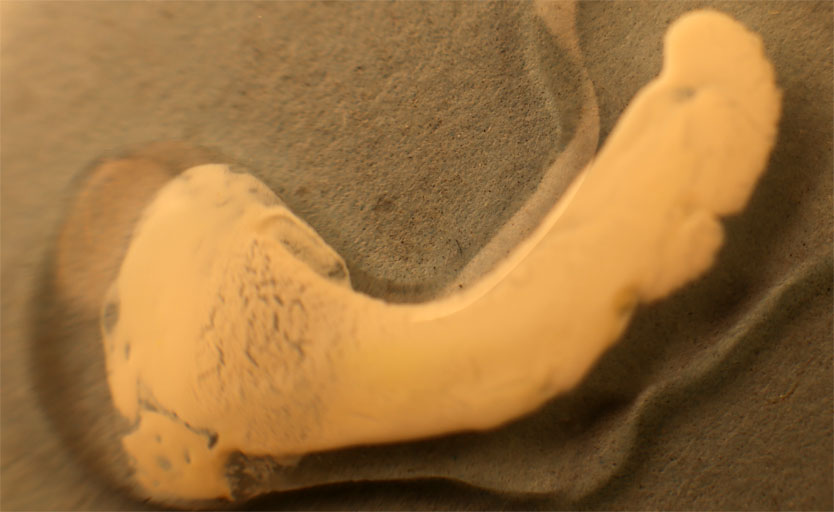
Fig.2
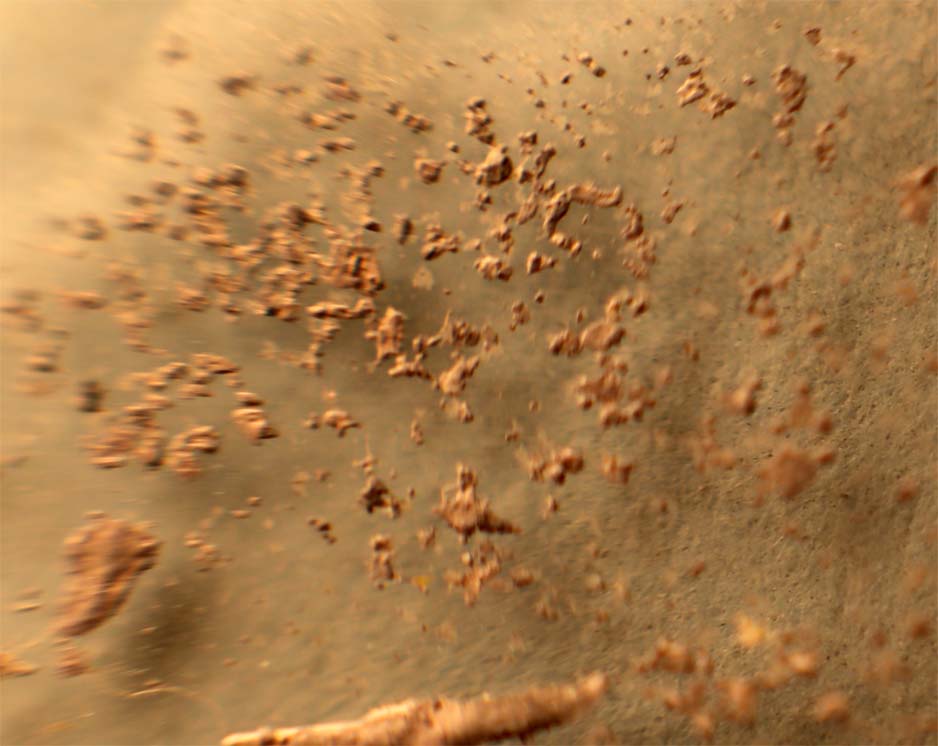
Fig.8

Fig.10 (Detalle)
Fig.9

Fig.4