Fig.5
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ELECTRÓLISIS DEL SULFATO DE CINC: EFECTO
DE LA VARIACIÓN DE LA DIFERENCIA DE POTENCIAL
ELECTRÓLISIS DEL SULFATO DE CINC (Continuación)
Se completa el estudio de algunos aspectos cuantitativos
de la electrólisis del sulfato de cinc
a través de la fotografía digital.
Se va a estudiar el efecto de la variación
de la diferencia de potencial al que se somete una disolución de sulfato de
cinc 1M, para eso se monta un dispositivo
de cubeta sobre papel milimetrado, con un cronómetro que visualizará en cada
instante el estado de la electrodeposición(fig.1)
El electrodo negativo, donde se produce la deposición
del cinc, se sitúa a la derecha, mientras que el positivo, donde se desprende
el oxígeno está a la izquierda de nuestra vista. La separación entre ellos
es de 60mm. El cronómetro hasta los treinta minutos visualizará las centésimas
de segundo. A partir de ellos, solo los segundos. Como lo que nos interesa
es la electrodeposición del cinc, sólo se tomará por lo general la zona del cátodo.
Las fotografías de las figuras 1, 2, 3, 4 y 5, se obtienen
en la electrodeposición del Zn, sometiendo la disolución a una tensión de
15V.
Fig.5
Fig.1
Fig.2
Fig.3
Fig.4
Fig.7
Como se observa en las fotos, la electrodeposición en estas condiciones enseguida toma forma arborescente, ramificán-dose rápidamente hacia el electrodo positivo. El cre-cimiento no es lineal, aunque muy rápido. En un minuto se observa un crecimiento longitudinal de 10 mm. Se aprecian las burbujas de hidrógeno, en la extensión del cátodo a través del cinc metálico (fig. 4 y 5).
En la zona del ánodo se produce una coloración amarilla por aparición de Fe3+, debido a la reacción del ácido sulfúrico con el metal del electrodo.
Si se rebaja la diferencia de po-tencial hasta 12V, se
obtiene la suce-sión fotos 6,7,8, y 9
Fig.6
Fig.8
Fig.9
Hasta ahora la diferencia en la forma de la electrodeposición
metálica del cinc, no ha variado, solo el tiempo. A 15V, prácticamente la
formación de cinc metálico había alcanzado a los 20 minutos, 50 mm
de distancia desde el cátodo, sin embargo con 12V, a los 30 minutos
sólo había avanzado 7mm., y sólo al cabo de 60 minutos llega a dicho
punto.
Fig.10
Fig.11
Fig.12
Fig.13
Fig.14
Fig.15
Fig16
Fig.17
Fig.18
Fig.19
Fig.20
Fig.21
Fig.22
Fig.23
Como se observa se ha producido una anomalía en la electrodeposición,
con una expansión del cinc, con un crecimiento muy rápido entre los 50 y los
65 minutos, crecimiento que despues se ralentiza.
Esta anomalía solo se ha producido con condiciones muy diferentes: disolución 0,05M
y diferencia de potencial 10V, de entre las 50 diferentes de las que se han
hecho fotos.
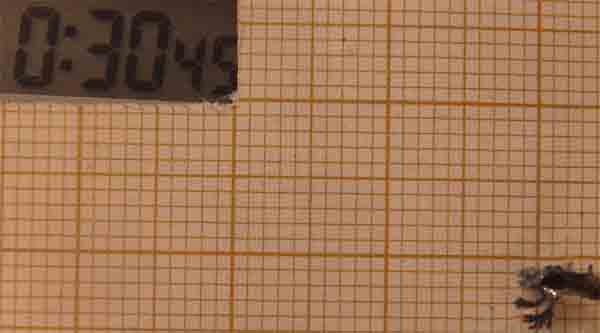
Fig.24
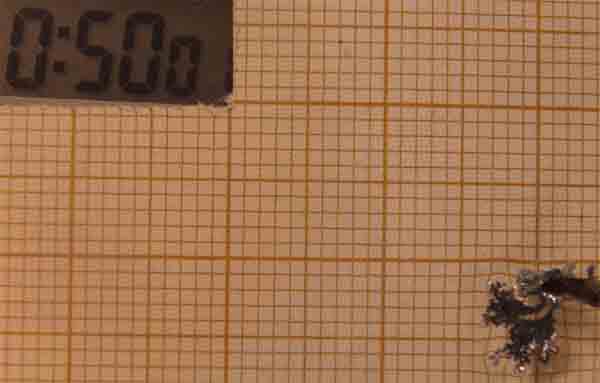
Fig.25
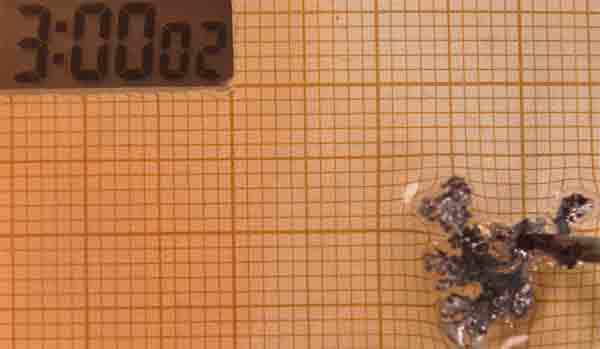
Fig.27
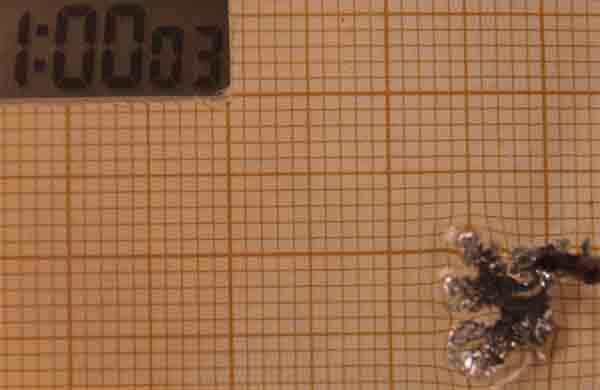
Fig.26