ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
INDICADORES QUÍMICOS ÁCIDO-BASE I
Introducción.
En 1664, Boyle escribió “The Experimental History of Colours”. En ella se inicia el reconocimiento de ácidos [1] y bases a través de los cambios de color de extractos de plantas [2] . A partir de Boyle, el cambio de color del jarabe de violetas, sirvió para indicar la presencia de un ácido; en este momento nacen los indicadores químicos. Sin embargo el primer reconocimiento, no lo fue con motivo de los cambios de color, ya que 8 años antes, Glauber había definido la “efervescencia del espíritu ácido” como señal inequívoca de su existencia [3] . En 1671, Duclós llama “turnesol” (litmus), a un indicador extraído de líquenes, que le da un gran resultado [4] . Casi cien años después, James Watt, el inventor de la máquina de vapor y nominador del caballo de vapor como unidad de potencia, descubre que la lombarda (col roja) es uno de los mejores indicadores.
Indicadores químicos ácido-base.
Un indicador químico es un ácido o base débil cuya forma disociada tiene diferente color que la forma sin disociar [5] , ello es debido a que están formados por sistemas resonantes aromáticos, que pueden modificar la distribución de carga según la forma que adopten. Esta alteración por el desplazamiento hacia una forma mas o menos disociada, hace que la absorción energética del sistema se modifique y con ello el color.
Se podría establecer un equilibrio de disociación para una forma de indicador ácido HIn:
HIn X In- +
H+
Color A
Color B
La aplicación de la ley de acción de masas a este equilibrio, nos da que:
, de lo que
.
Si el medio es ácido, y aumenta la concentración de H+, deberá
disminuir la relación [In-]/[HIn].
Para ello el equilibrio tendrá que desplazarse hacia la izquierda, aumentando
la concentración de HIn, y dominando su color. Si el medio es básico,
el cociente tendrá que aumentar, desplazándose
el equilibrio hacia la derecha y dominando el color B. Naturalmente como
se trata de un equilibrio, coexisten las dos formas, y por ello el color
que toma procede de la mezcla de colores y de su proporción. Como los
indicadores tienen diferentes constantes de equilibrio, por eso cambian
de color en distintos intervalos
de pH, esto suelo ocurrir aproximadamente a pH=pK"1 . Cuando coexisten varios equilibrios entre formas
tautómeras, hay varios pK, y por lo tanto más de un cambio de color.
Indicadores químicos ácido-base
naturales.
Se deben fundamentalmente a la proporción que contengan de los pigmentos
naturales conocidos como antocianinas y antoxantinas. La antocianina es
roja en medio ácido, púrpura en medio neutro y azul en medio básico, sin
embargo la antoxantina es amarilla en medio básico. La proporción en que
se encuentre la mezcla de pigmentos hace que las flores tengan distintos
colores y que se puedan modificar según el pH del medio.
Son glucósidos,
con estructura parecida, modificándose la posición de determinados grupos
hidroxilo, con carácter ácido, que según el medio producen diferentes
formas encuadradas en una tautomería ceto-enólica. De su hidrólisis se
extraen los pigmentos coloreados, las antocianidinas y antoxantidinas
Así la forma más genérica de las
antocianidinas, y su transformación sería (fig.1):
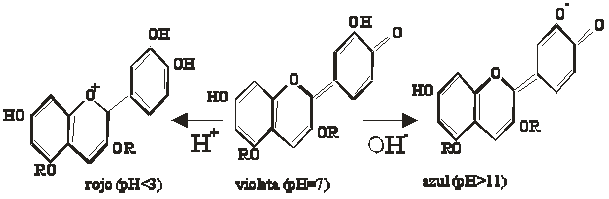
Fig.1
Mientras que para las antoxantidinas, sería (fig.2):
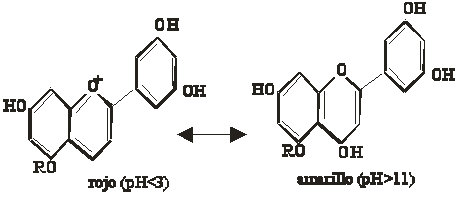
Fig.2

fig.3
La mayoría de los pétalos de las flores contienen
ambos pigmentos, por eso en medio ácido el jarabe de violetas producía
color rojo, mientras que en medio básico era verde, combinación del amarillo
y del azul, tal como se muestra en la simulación (fig.3). Si domina más
la concentración de amarillo, será verde amarillento.
Prácticas de indicadores químicos
ácido-base naturales.
1. Con el extracto de violetas.
Dado que históricamente fue el primer indicador, comenzaremos por él.
Se cortan las hojas de violeta con cuidado y se extrae en una termobatidora, en caliente con agua hasta 80ºC.
(25g de pétalos de violetas/ 50g de agua).El extracto toma color violeta
pálido, casi incoloro (según la concentración).
En el primer modelo de prácticas, observaremos a través de química de
la gota de extracto de violetas en agua, la coloración que toma un ácido
fuerte (H2SO4 6N), un ácido débil (acético 1M), una base débil (hidróxido amónico 1M) y una
base fuerte (NaOH 6N). De esa forma
se dispondrán en la caja Petri 4 gotas
de los compuestos citados, rodeando unas gotas de indicador (fig.4).
Posteriormente se pondrán en comunicación las gotas (fig.5), continuando
con las figuras 6 y 7.
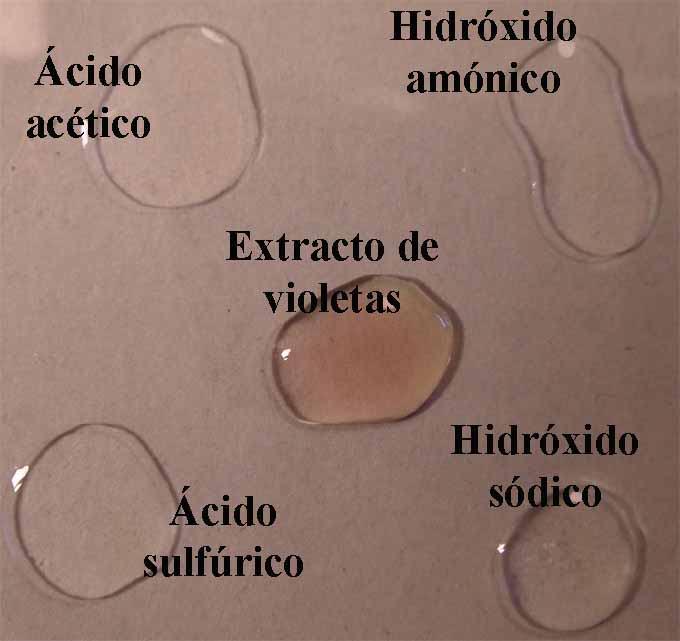
Fig.4
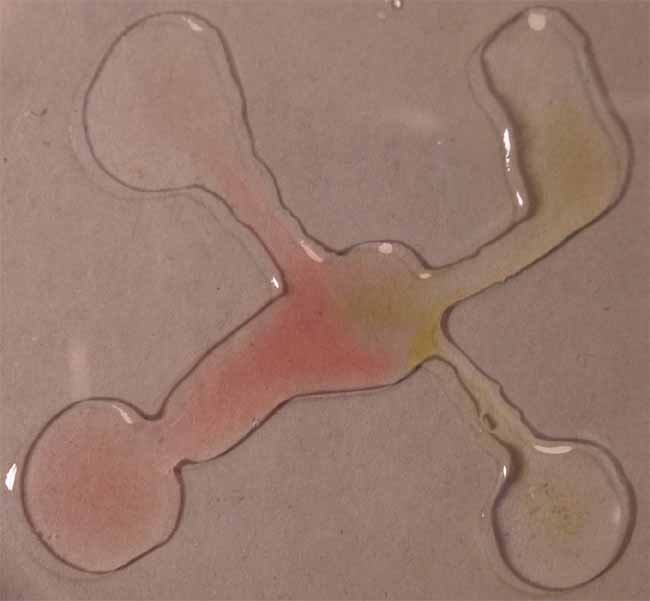
Fig.5
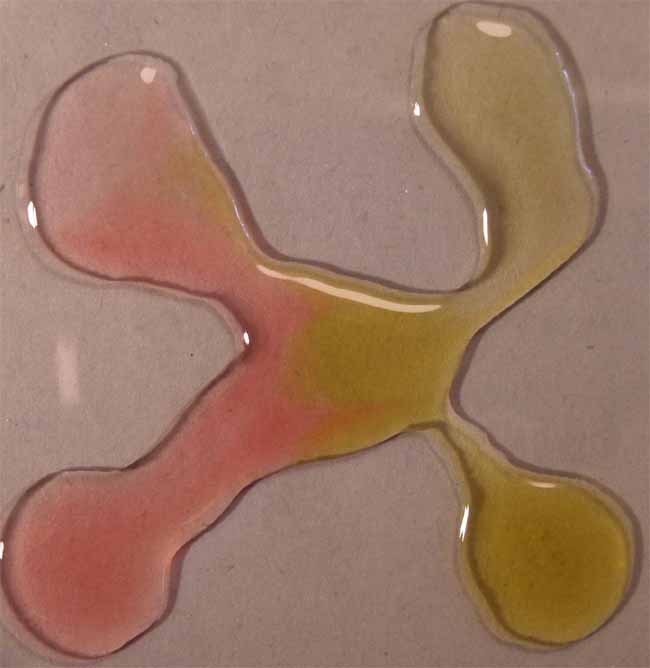
fig.7
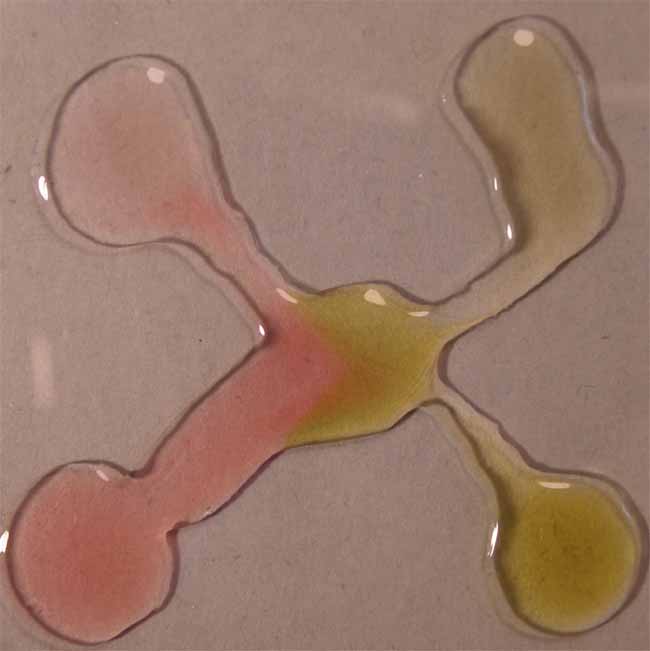
Fig.6
Como se observa a pH ácidos toma color rojizo,
mientras que a pH básicos el color es verde amarillento, tal como se decía
en los primeros estudios con indicadores naturales.
2. Con extracto de lombarda.
La lombarda se extrae en una termobatidora,
en frío con alcohol absoluto (50 g de lombarda troceada/ 100ml de etanol
absoluto), y en caliente con agua hasta 80ºC. (250g de lombarda/ 500g
de agua).El extracto alcohólico toma color rojo pálido, casi incoloro
(según la concentración), mientras que el acuoso lo hace violeta.
En el primer modelo de prácticas, observaremos a través de química de
la gota de extracto de lombarda en agua, la coloración que toma un ácido
fuerte (H2SO4 6N), un ácido débil (acético 1M), una base débil (hidróxido amónico 1M) y una
base fuerte (NaOH 6N). De esa forma
se dispondrán en la caja Petri 4 gotas
de los compuestos citados, rodeando unas gotas de indicador (fig.8).
Posteriormente se pondrán en comunicación las gotas (fig.9).
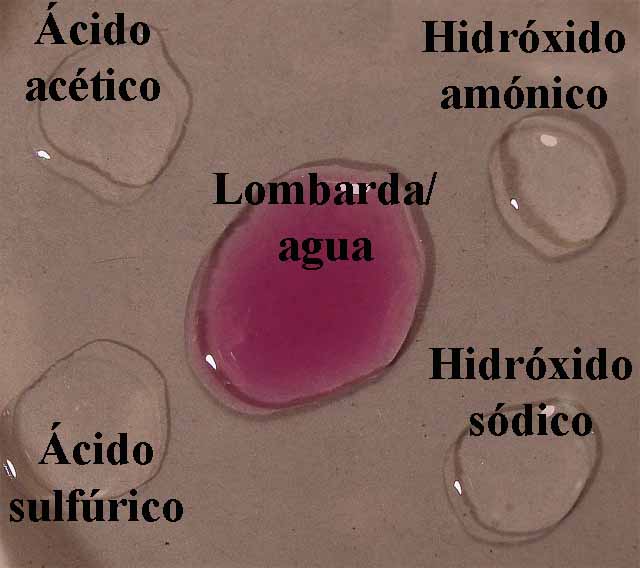
Fig.8
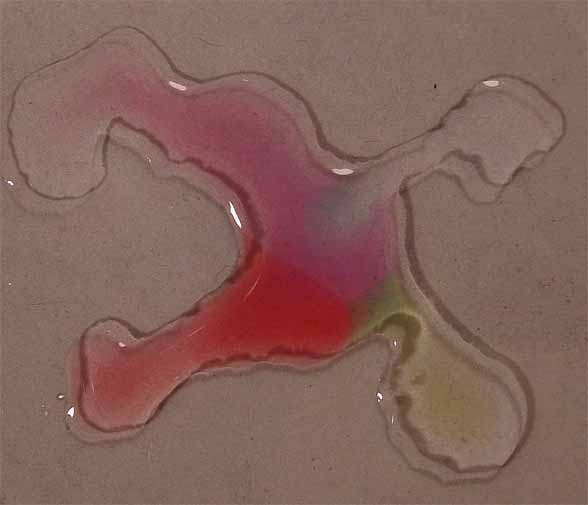
Fig.9
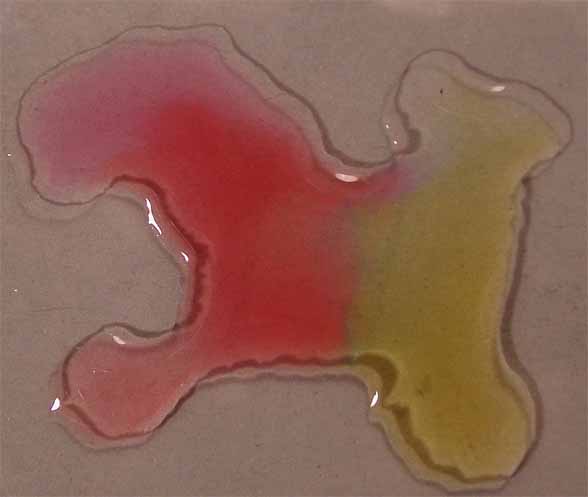
Fig.11
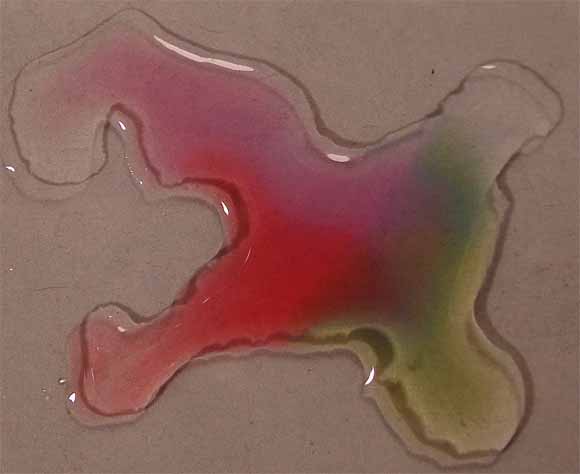
Fig.10
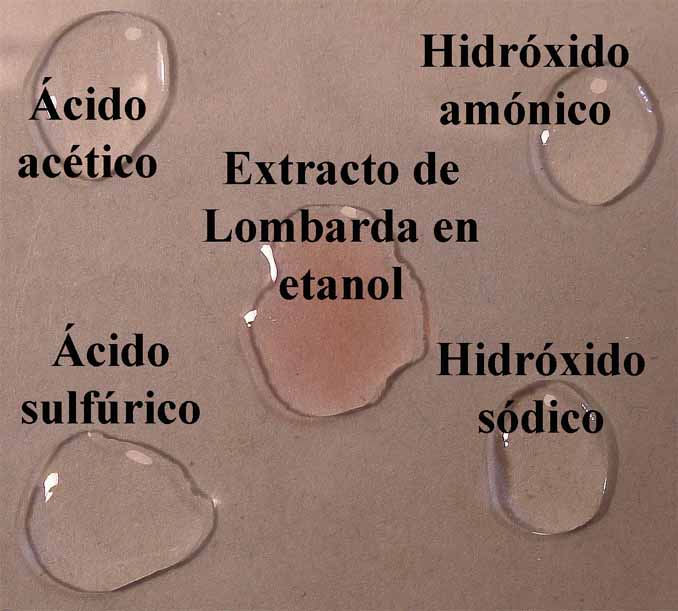
Fig.12
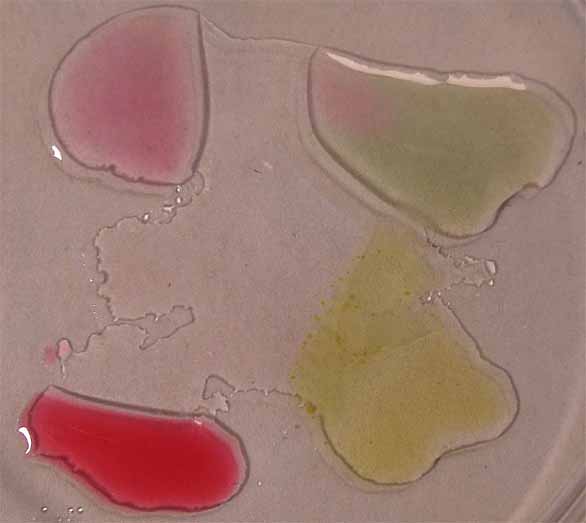
Fig.13

Fig.15
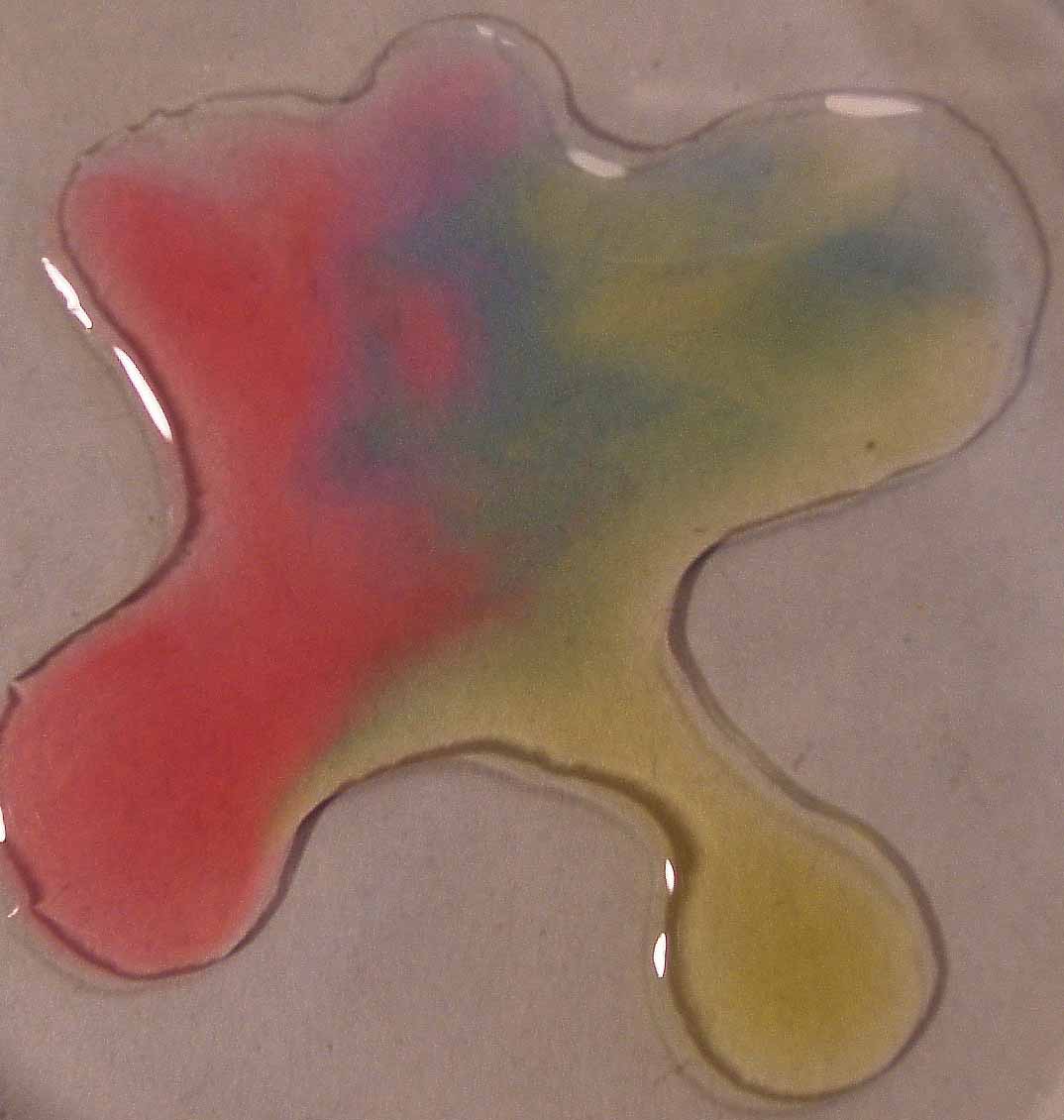
Fig.14
Los cambios de color corresponden a los que toma para los diferentes pH,
que se obtienen de la combinación de las gotas de los reactivos respectivos,
según la tabla que se da:
| Valores
de pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
| Lombarda en agua |
Rojo |
Rojo violáceo |
Azul
verdoso |
Verde |
Amarillo |
||||||||
| Lombarda en etanol |
Rojo |
Desde
Violeta a azul pálido |
Verde |
Verde
amarillento |
Verde
azulado |
||||||||
3.
Con extractos de pétalos de ciclamen rojo, similar a los
pétalos de rosa roja.
Se extrae con etanol absoluto, en frío, después de trocear los pétalos.
Aproximadamente 25 g de pétalos con 50 mL de etanol). Se sigue el procedimiento
habitual, obteniéndose la sucesión de figuras que se indica a continuación.
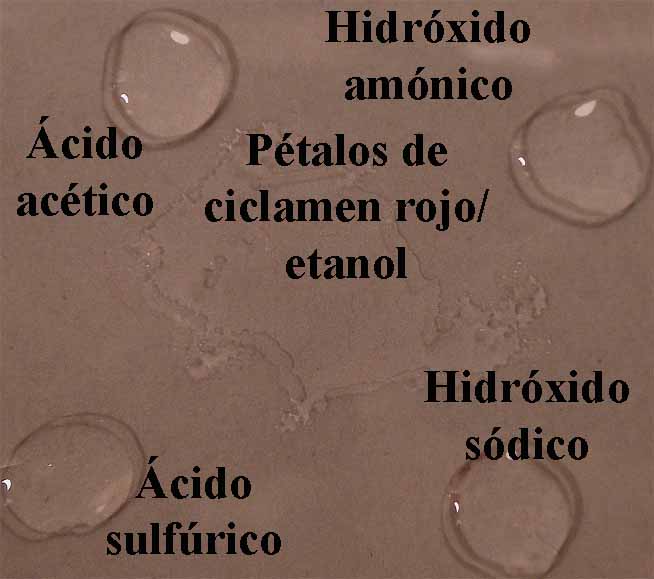
Fig.16
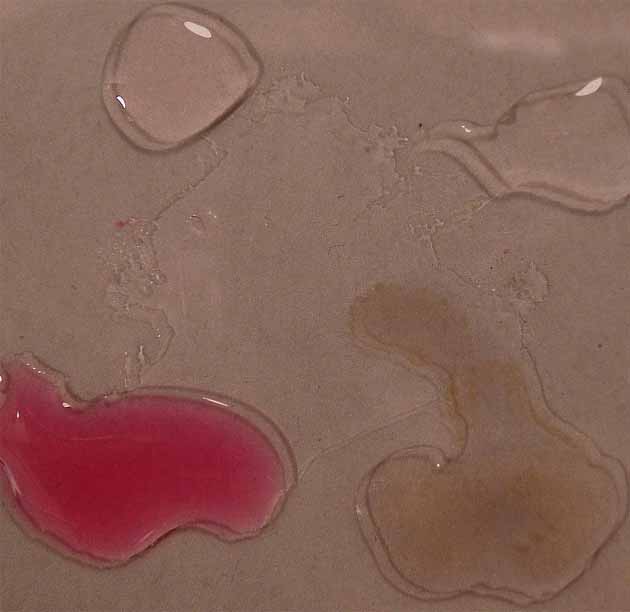
Fig.17
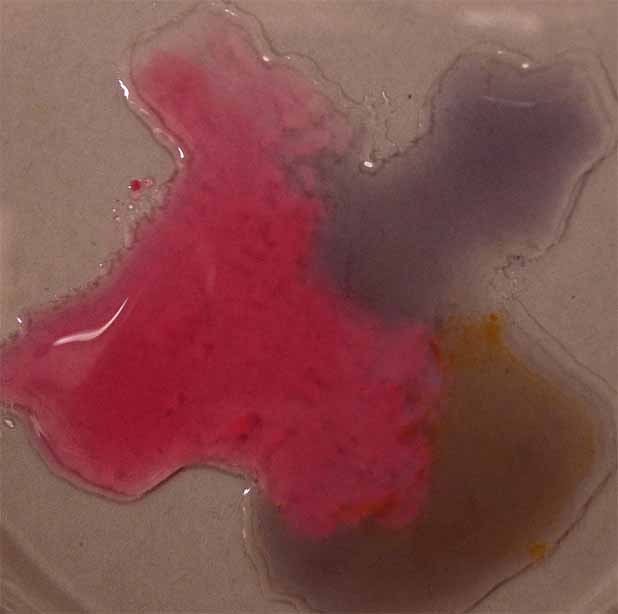
Fig.19
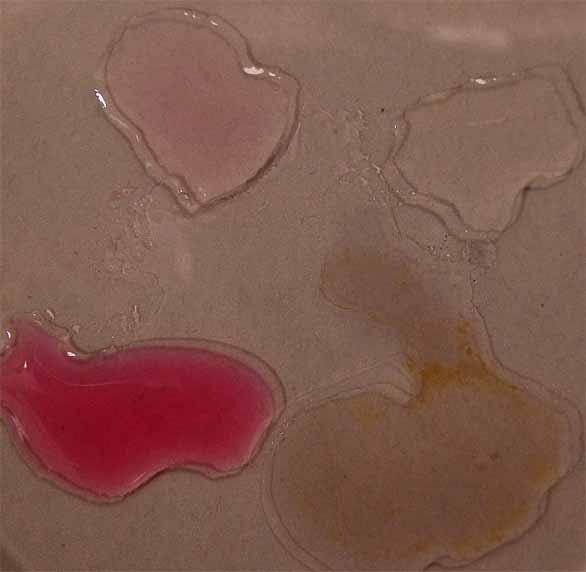
Fig.18
Como se aprecia en la sucesión de fotos (fig
16, 17, 18 y 19), existe una diferencia sustancial frente a la lombarda,
y es que en medio fuertemente básico, el color es marrón oscuro, mientras
que en medio débilmente básico aparece violeta pálido.
| Valores
de pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
| Ciclamen/ etanol |
Rojo pálido |
Desde
rosa a violeta casi incoloro |
Marrón
amarillento |
Marrón
verdoso |
|||||||||
4. Con extracto de fresas en etanol
absoluto.
Siguiendo el procedimiento habitual de unir las gotas (fig.17 y 18), se
observa que a pH bajos, toma color naranja, pero si es algo es amarillo,
con tintes violáceos. Si los pH son intermedios casi no se aprecia cambio
de color (fig 19 y 20).
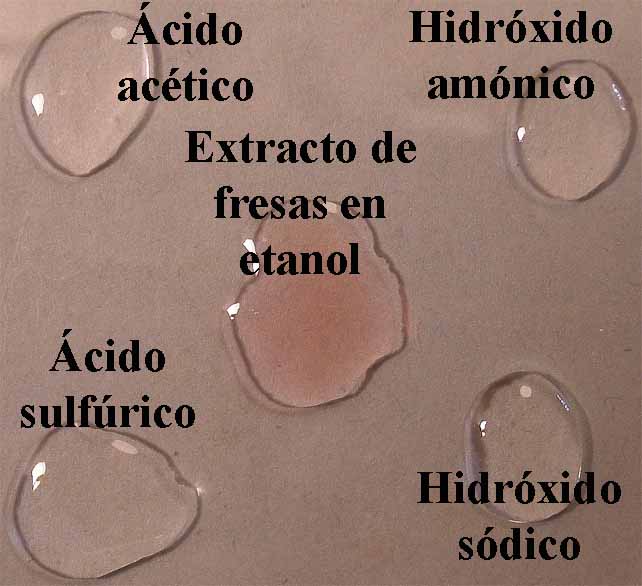
Fig.20
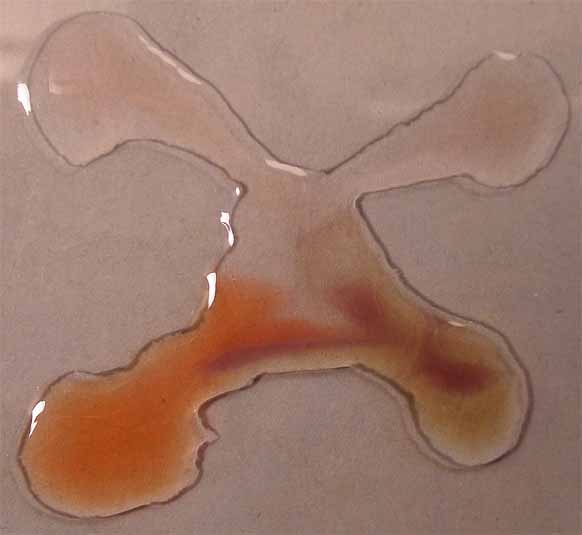
Fig.21

Fig.23

Fig.22
5. Con tornasol (extracto de
líquenes de los géneros Rocella, Variolaria y
Lecanora).
Los colores son
muy débiles, en medio ácido tiende al rosa, y medio básico al azul grisáceo.

Fig.24
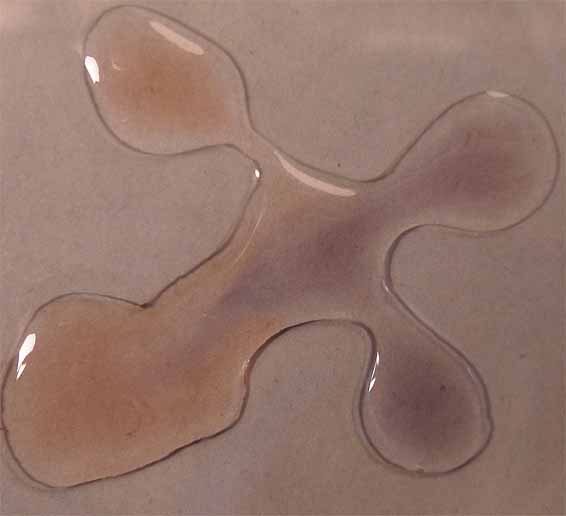
Fig.25
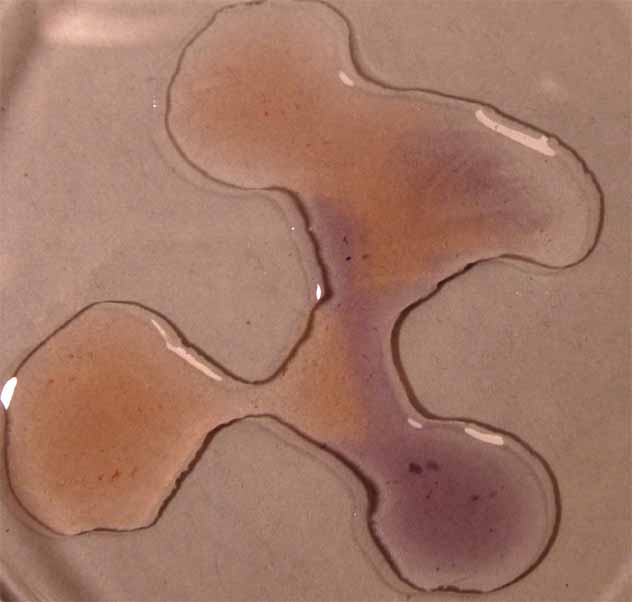
Fig.26
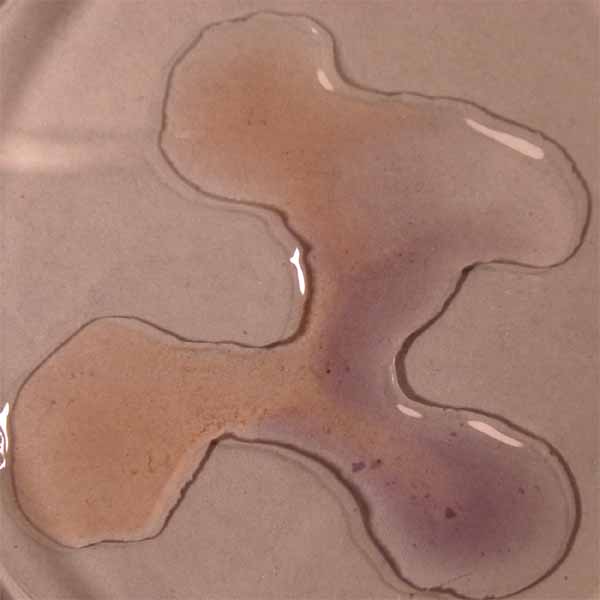
Fig.27
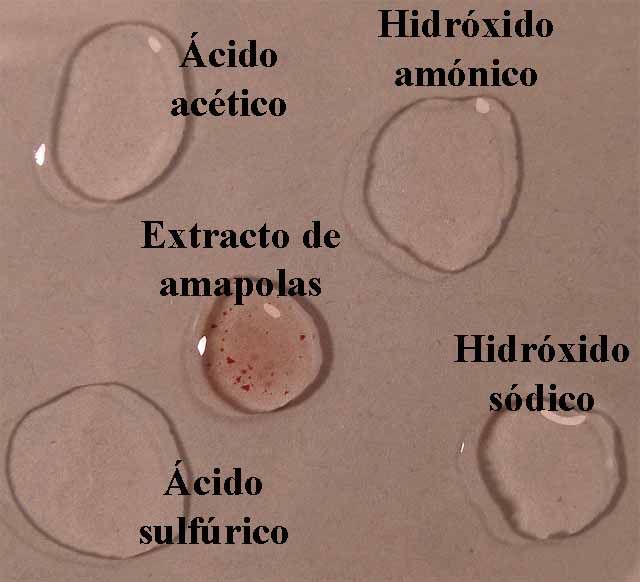
Fig.28
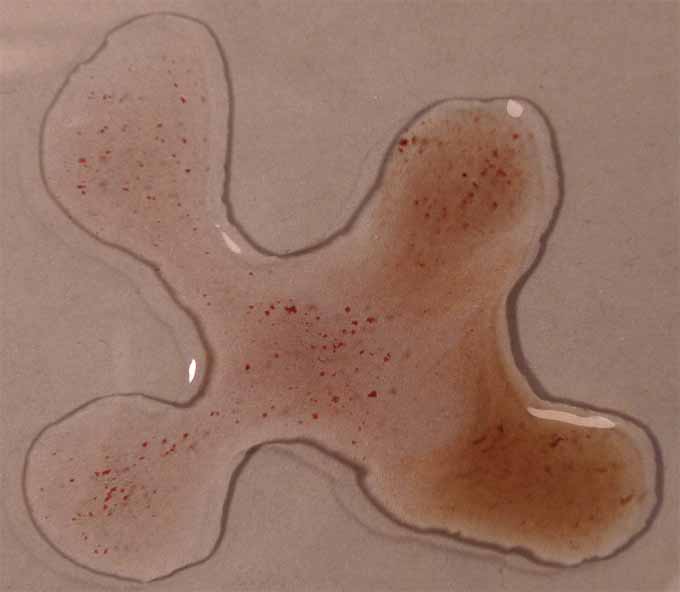
Fig.29
Fig.30
[1]
El concepto de ácido según Partington, ya aparece
en el manuscrito indio Rasarnava, 1200 años A.C. Las bases eran conocidas
como álcalis, debido a que el mas conocido (carbonato potásico) se extraía
de las cenizas de la planta Kali (La primera referencia se da en
la obra de Abu Mansur Monafir, siglo X d.C.). Existen referencias más
antiguas, ya que en las tablas sumerias las cenizas vegetales eran conocidas
como Te-Gaz. En el primer diccionario de Química publicado por Macquer
en 1766, aparece como definición de los álcalis: sustancias que “vuelven
verde el jarabe de violetas”.El término base, surge a mediados del
siglo XVIII, y se debe al químico francés Rouelle, ya que eran la base
de la formación de las sales al combinarse con los ácidos.
[2]
Escribe Robert Boyle:” Take good syrup
of violeta, impregnated with he tincture of the flowers, drop a little
or it upon a white paper (for by that means the change of colour will
be more conspicuous, and the experiment may be practised in smaller
quantities) and on this liquor let fall two o three drops of spirit,
either of salt or vinegar or almost any other eminently acid liquor,
and upon the mixture of these you shall find the syrup immediately turned
red”.
[3]
Actualmente sería el desprendimiento de dióxido de
carbono (antes gas silvestre, o gas fijo), cuando actúa sobre un carbonato.
[4]
El término tornasol, se conocía desde Plinio (I d.C.)
y Dioscórides, aunque aplicado a determinadas plantas (heliotropo).
Como colorante aparece mencionado en el “Art of Drawning”, de Peachan,
publicado en 1606.El litmus, o littmose, aparece en uso desde 1518,
derivado de lit (color) y mouse(aplicado a
determinado tipo de plantas), por lo que vendría a ser un colorante
extraído de plantas, como lo es en realidad.
[5]
Esta
definición fue propuesta por Ostwald, en 1891, y publicada en 1894,
en un contexto mucho mas amplio bajo el título:”Die
wissenschaftlichen Grundlagen der analytischen Chemic”.