Fig.33
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ASPECTOS
ATÓMICOS DEL HIERRO EN LA VIDA DEL HOMBRE (Continuación): Los Efectos
Consecuencias estructurales del descenso del Fe(II): Efecto Rube Goldberg
.
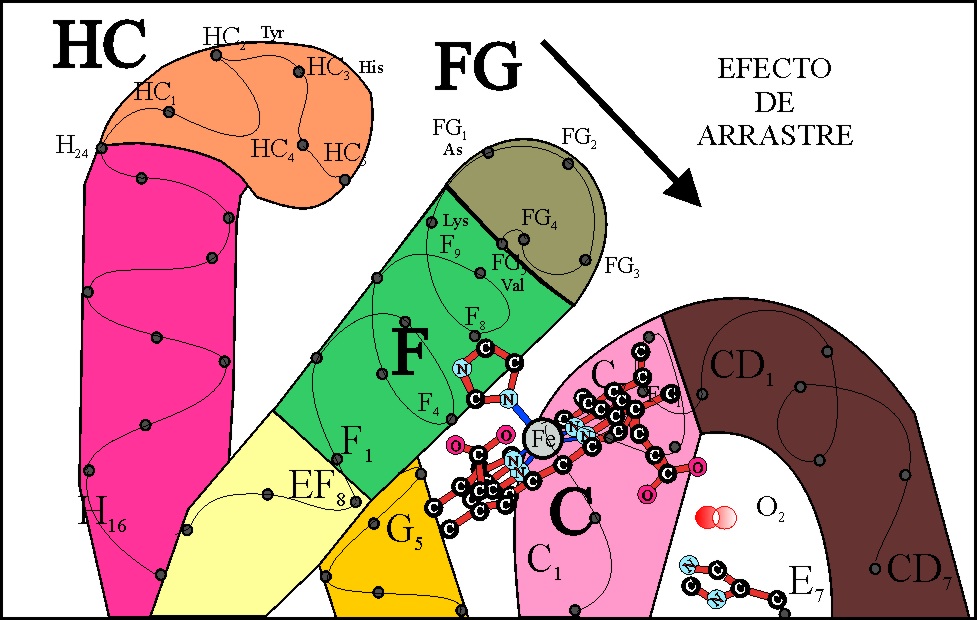
La zona conflictiva, inicial que
va a arrastrar el descenso del Fe(II) sobre el plano del hemo, se aprecia
en la figura 33.

Fig.33
Sin embargo, no todo es tan fácil
porque en su descenso se van a enfrentar
el C4 del imidazol y un nitrógeno de los núcleos pirrólicos produciendo
una repulsión estérica que será la clave de los cambios estructurales y efectos
cooperativos desde la desoxihemoglobina en la cual los cuatro monómeros se
encuentran tensos (forma T o A) dejando el hueco en el medio (como ya se ha
explicado), hasta la oxihemoglobina
en la que las unidades β se aproximan produciendo una estructura relajada
(forma R o B). De esa forma se desencadenará un complejo mecanismo de palancas,
giros, rupturas de enlaces y desplazamientos, denominados efecto Rube Goldberg
[11]
. Veremos que sin ese mecanismo, la hemoglobina, aún
habiendo captado el oxígeno a través del complejo con el ión ferroso, no podría
transportarlo a los tejidos.En principio la estructura del tetrámero hemoblogina sin oxígeno sería la dada en la fig.34
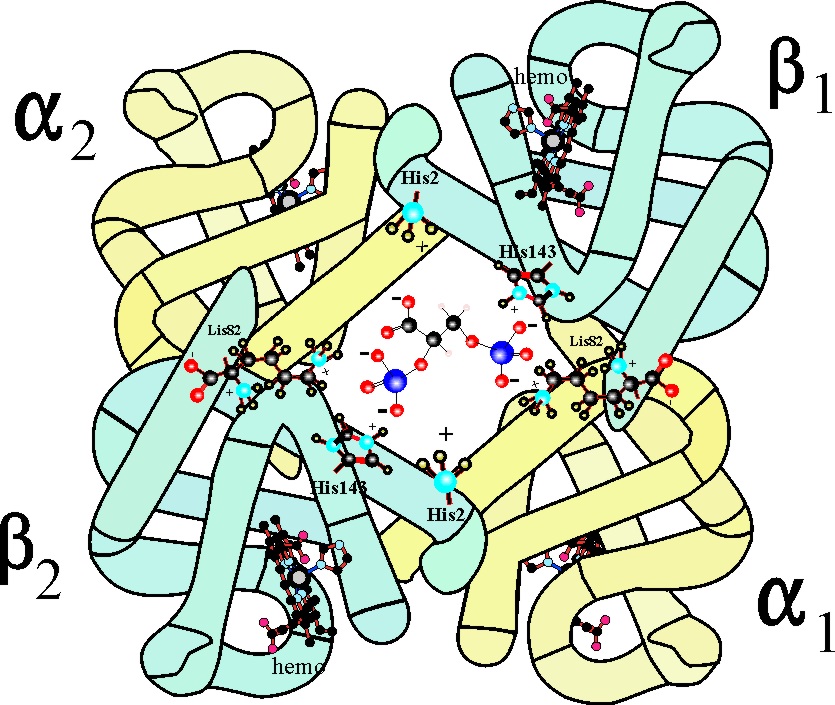
Fig.34
Recordemos que en principio las
cadenas β no se podían aproximar porque dirigían los terminales positivos
de los aminoácidos (-NH3+), hacia adentro y por lo tanto
se repelían equilibrándose con difosfoglicerato negativo, situado en el hueco.
Pues bien, debido a la repulsión estérica encontrada en el descenso, la hélice
F que va a ejercer de palanca sobre toda la subunidad, tiene que girar aproximadamente
15E, con lo cual el tramo H se separa, aflojándose el enlace
por puente de hidrógeno que existía y mantenía la estructura, entre la tirosina
145 (HC-2) y el carbonilo de la valina
98 (FG-5).
Al aflojarse el enlace, la tirosina
(Tyr) no cabe en el hueco girando hacia
afuera y rompiéndose el puente salino intramolecular próximo al enlace de
hidrógeno entre la histidina 146 (His) (HC-3) grupo =NH2+
y el terminal -COO- del aspártico 94 (As) (FG-1) (Fig.35)
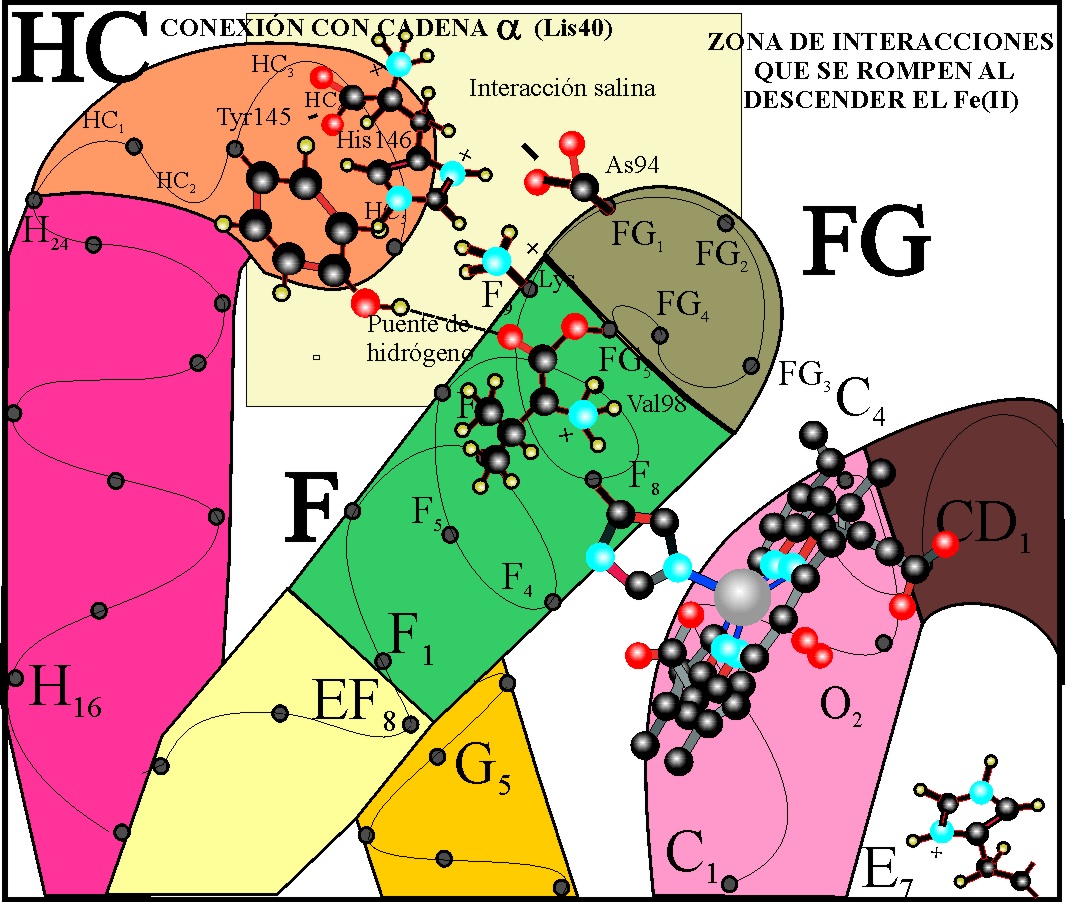
Fig.35
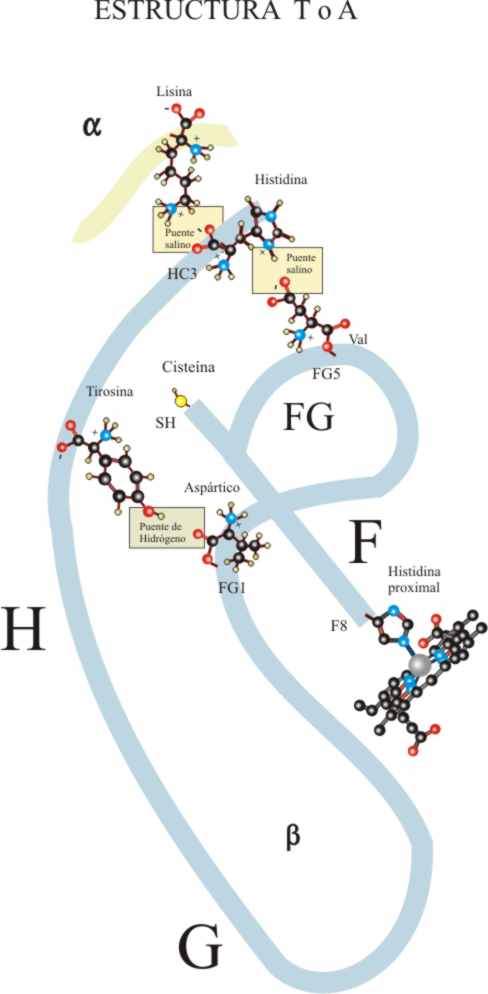
Fig.36
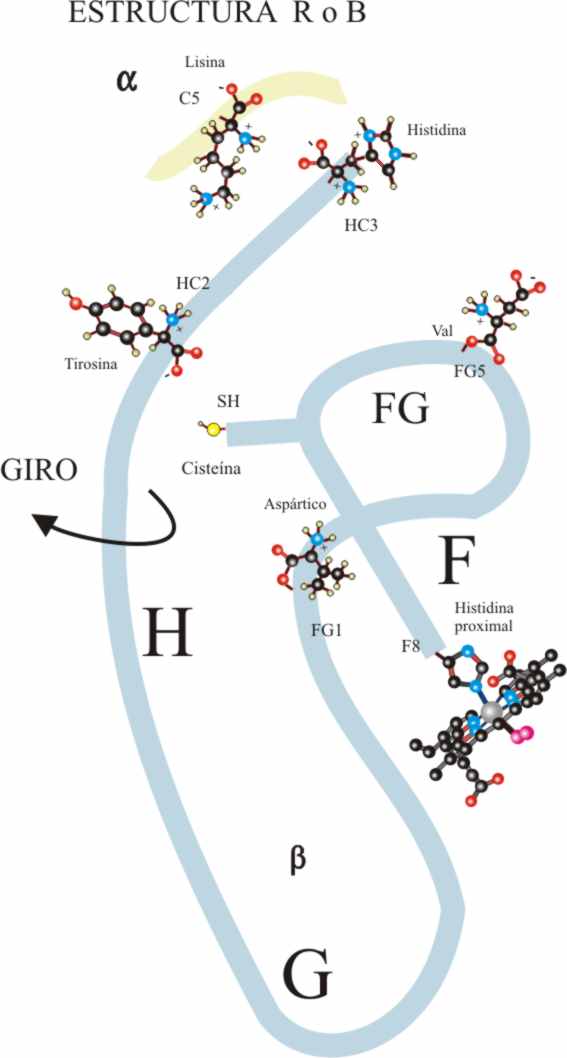
Fig.37
Todo este movimiento del tramo
H de la cadena β con ruptura de enlaces internos, hace que quede mucho
más libre, provocando también la del enlace salino que mantenía unida dicha
cadena a la α inmediata o sea
entre el terminal acídico de aquella y la lisina 40 (C-5) de ésta, trasmitiéndose
el movimiento a toda la subunidad α2 que también gira, desencontrándose
su cabeza NH3+ que formaba el puente salino con la cola
de la α1 y rompiéndose las uniones salinas α2-α1,
con lo cual se abre todavía más el hueco entre ellas.
El giro de la cadena β1 provoca que los restos positivos
no se enfrenten a los de la β2 pudiendo aproximarse entre
sí las cadenas y eliminando el difosfoglicerato que no cabía ya en el hueco.
Pese a todo ello se mantienen 17 de
los 19 enlaces por puente de hidrógeno que se establecían entre la α1-β1
y la α2-β2, y no se modifican las uniones
entre las cadenas α.. Obsérvense la interacciones iónicas entre el DPG
y las unidades beta (fig.38)
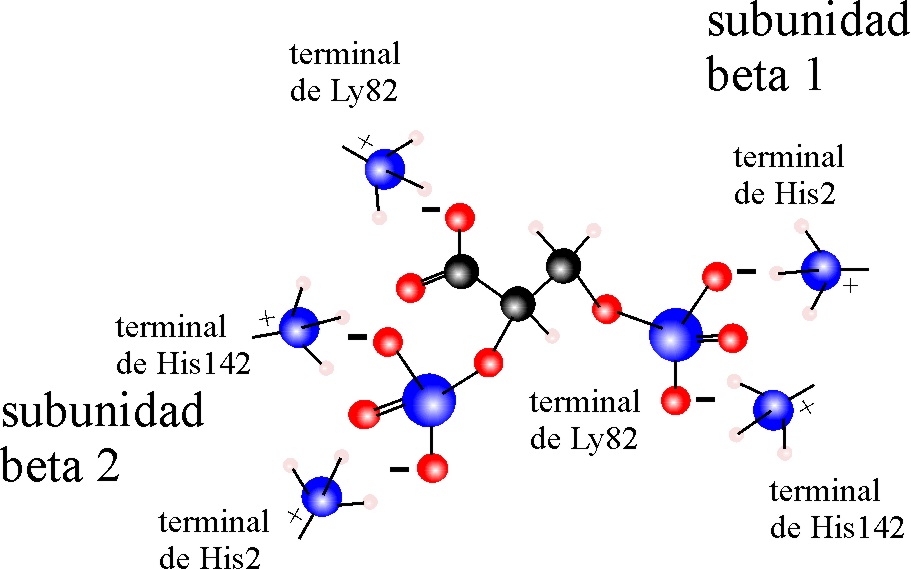
Fig.38
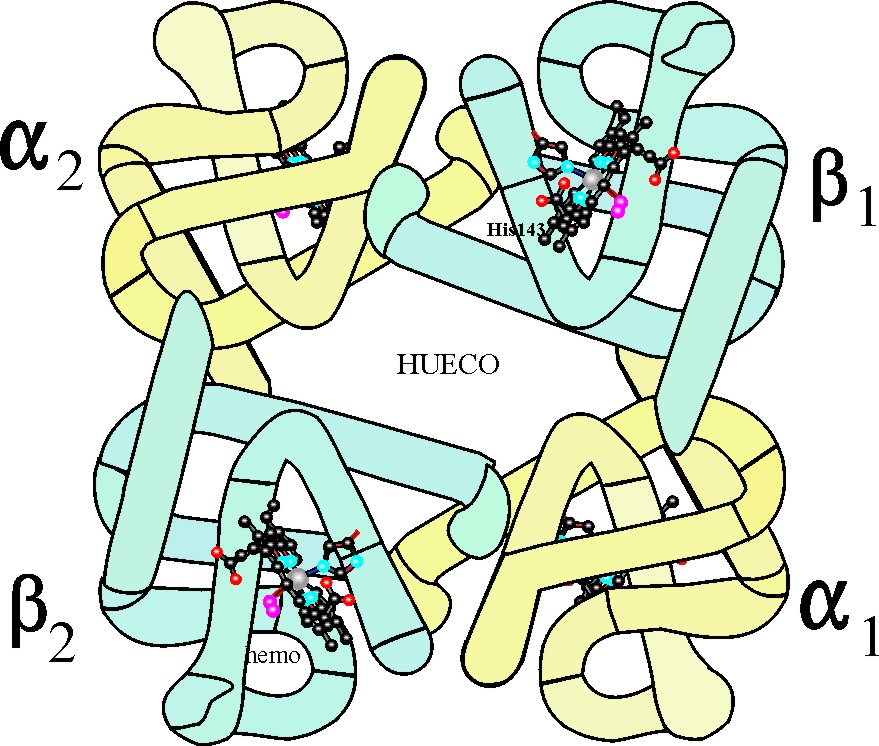
Fig.39
Estos son los hechos clave que
darán lugar a la cooperatividad entre las diferentes subunidades α
y β de la hemoglobina que hace que se produzca una estructura relajada
la cual favorecerá la entrada de más oxígeno por disponer de más espacio para penetrar, al ser mayor la cavidad
del complejo hemo.
Si aumentara la concentración de
2,3-difosfoglicerato (DPG), disminuiría la afinidad de la hemoglobina por
el oxígeno
[12]
. Esto ocurre al aumentar la altitud, y causa notables
perjuicios a los montañeros. De esa forma la afinidad de las siguientes
subunidades con el oxígeno se incrementa de forma considerable
a causa de la ruptura de los puentes salinos cuya interacción de
tipo iónico se debilita fácilmente al aumentar la distancia de separación
entre las diferentes subunidades.
También en la sangre almacenada
aumenta la afinidad por el oxígeno, por
disminución de la concentración de DPG. El proceso contrario ocurre en muchas
enfermedades. El aumento en los niveles de DPG se encuentra en una serie
de enfermedades cuando está alterada la absorción del oxígeno. Los pacientes
con anemia, con gasto cardíaco inaecuado o con los pulmones dañados, registran
tasas altas de DPG. Por eso en enfermedades como el efisema pulmonar, debido
al aumento de la concentración de DPG, la cantidad de oxígeno transportada
es menor, y por ello no se pueden realizar esfuerzos físicos. El DPG, se
une peor a la hemoglobina fetal que a la normal, lo cual es la causa de
que el feto tenga mas oxígeno, ya que la sangre materna lo liberará en beneficio
de la fetal.
Se ha dicho que la coordinación
del ligando oxígeno es sucesiva, de forma que cada unión afecta las siguientes
uniones, debido a la rotura de enlaces, aumentando la afinidad de cada monómero
por el oxígeno, este efecto se denomina alostérico (del griego “otro espacio”),
por eso la hemoglobina es una proteína alostérica, cosa que no ocurre con
la mioglobina, y por eso presentan curvas de afinidad diferentes frente
al oxígeno.
[11]
Rube Golberg es un dibujante y caricaturista
norteamericano, que se caracteriza por las poleas, palancas y equilibrios
en sus dibujos
[12]
Los profesores Benesch de la universidad de Columbia,
Chanutim y Curnish de la de Virginia demostraron que la sangre sin DPG,
tenía una afinidad por el oxígeno cinco veces mayor.