ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA

a)
La 1 b) La 2 c) La 3 d) La 4
283.La base de
la calorimetría es el método de las mezclas, y el principio fundamental es que en
un sistema aislado el calor cedido por el cuerpo a mayor temperatura es igual
al absorbido por el que está menor hasta que se igualan éstas. Así si en la
gráfica de la figura, en un sistema aislado dispones en A de 100g de agua a
80ºC, y en B, un bloque de hielo flotando, al mezclarlos, al cabo de 45s, dirás
que la masa de agua que hay al final es de aproximadamente:
a) 110g b) 150g c) 200g d)300g
DATO: Calor de
fusión del hielo=3,3.105J/kg Calor específico del agua a 4180J/kg.K
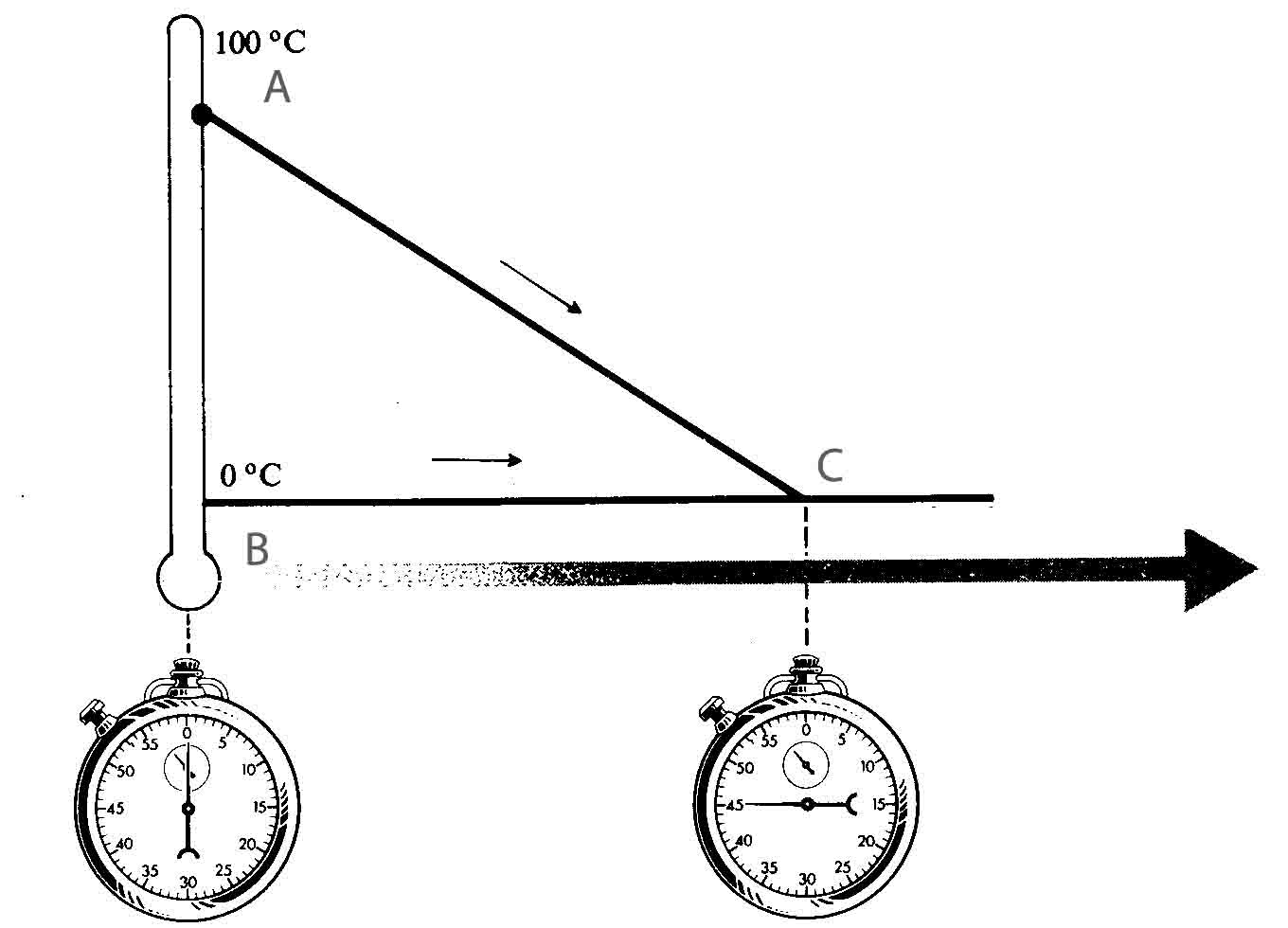
289*. Dispones
en A de un bloque de hielo flotando en el agua. El sistema alcanza el
equilibrio en la situación B.
Dirás que :
a) En A la
temperatura del agua era superior a 0ºC
b) En B la
temperatura es de 0ºC o superior
c) En A la
temperatura era del agua era de 0ºC
d) En B la
temperatura es superior a 0ºC
284. En el
recipiente dado se mezclan, dos cuerpos homogéneos y de la misma sustancia, siendo la masa de A,
1,5 veces la de B, y su temperatura inicial , la tercera parte de la de B,
dirás entonces que la temperatura final de la mezcla será respecto a la de A:
a) Igual b)9/5 c)3/5 d)2/5
285. En el
sistema de la figura, se disponen en el calorímetro,, en m1 200g de agua, en la que flota un bloque de hielo de 10g, mientras que en m2,
es 100 de agua marcando t2, 80ºC.
Se agita convenientemente, de forma que al final t1=t2.
En este casi dirás que la temperatura que marcarán los termómetros será de:
a)20ºC b) 30ºC c)25ºC d)
35ºC
DATOS: Calor de
fusión del hielo=3,3.105J/kg Calor específico del agua a 4180J/kg.K
286*. En el
sistema calorimétrico de la figura, dispones en A, 1litro de agua a 80º, y en B
un boque de 50g de hielo flotando de 200g de agua. La observación de la figura
te permitirá asegurar que:
a) Todo el hielo
se fundirá
b) En D, solo
hay agua a 0ºC
c) La
temperatura final de la mezcla es de 63,7ºC
d) La potencia
empleada para calentar el sistema a menor temperatura fue de 1000w
DATOS: Calor de fusión del hielo=3,3.105J/kg Calor específico del agua a 4180J/kg.K
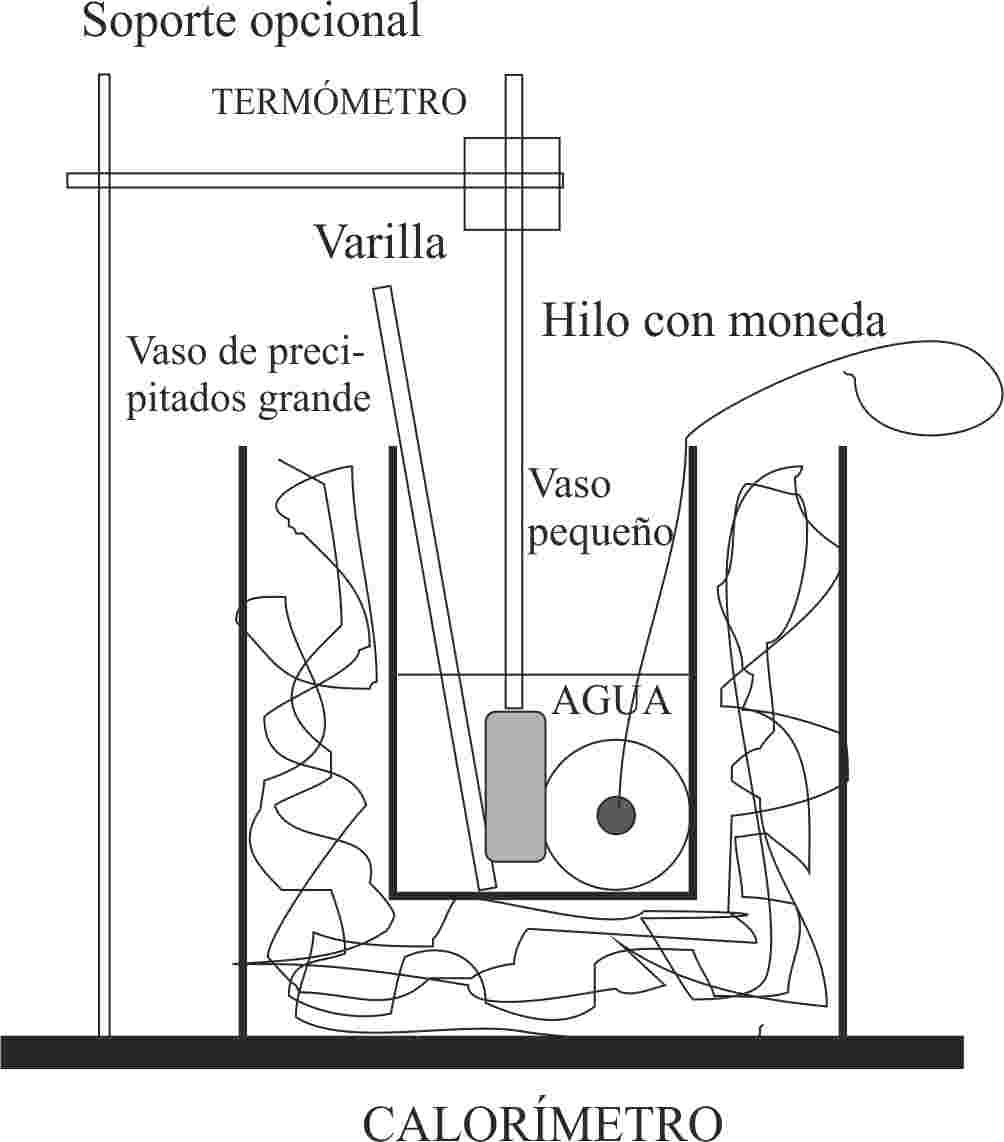
287.En el
calorímetro de la figura, de capacidad calorífica despreciable, se introduce una
pieza metálica de hierro, de masa m, a 90ºC en 100mL de agua a 22ºC, se agita,
y al cabo de cierto tiempo el termómetro marca 25ºC, dirás entonces que la masa
metálica era en gramos de:
a) 41 b) 50 c) 44 d)
25
DATOS:
Calor específico del hierro: 440J/kg.K.
Calor específico del
agua=4180J/kg.K
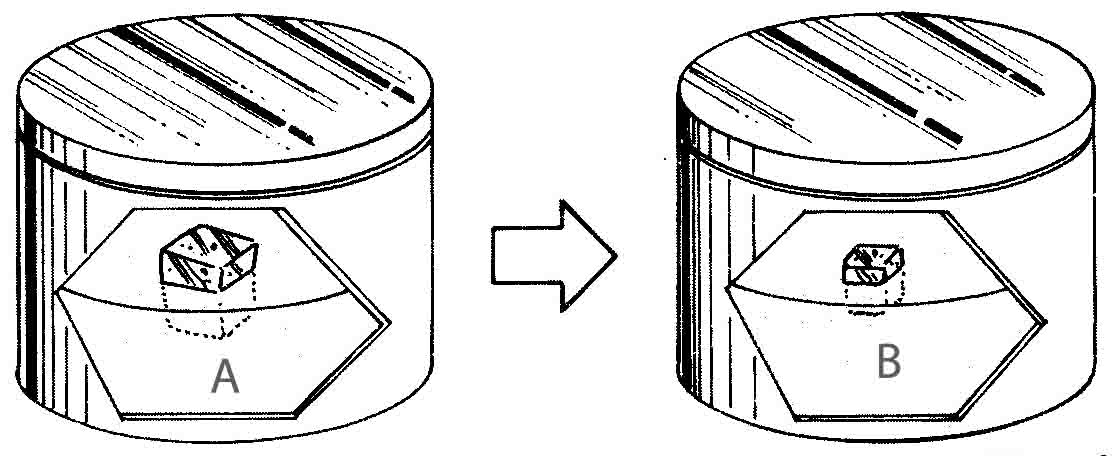
288*. Dispones
en A de un bloque de hielo flotando en el agua. El sistema alcanza el
equilibrio en la situación B.
Dirás que :
a) En A la
temperatura del agua era superior a 0ºC
b) En B la
temperatura es de 0ºC
c) En A la
temperatura era del agua era de 0ºC
d) En B la
temperatura es superior a 0ºC
290. Un bloque
de platino de 60g es retirado rápidamente de un horno y situado en un calorímetro
de cobre de 100g, que contiene 340g de agua. Si la temperatura del agua subió
de 10 a 12ºC, y con los datos que te dan dirás que la temperatura del horno en
grados centígrados será aproximadamente de:
a) 200 b) 300 c) 400 d)500
DATOS:
Calor específico del platino=146,3J/kg.K. Calor específico del agua=4180J/kg.K
Calor específico del cobre=418J/kg.K
291. En
muchos problemas de calorimetría, en vez de determinar el calor absorbido por
el calorímetro, lo que se determina o te dan es su equivalente en agua, esto es
la masa de agua que absorbería la misma cantidad de calor que el calorímetro.
Así si un termómetro de mercurio de 100g se calienta hasta 150ºC,y se introduce
rápidamente en un calorímetro, cuyo equivalente en agua es 250g, y la
temperatura del sistema agua calorímetro se eleva de 15 a 19ºC, dirás que las
masas respectivas de mercurio y de vidrio serán en gramos:
a) 75 y 25 b) 73
y 27 c) 70 y 30 d) 50 y 50
Calor específico del mercurio=125,4J/kg.K. Calor específico del agua=4180J/kg.K
Calor específico del vidrio=836J/kg.K
292.
Muchas veces en los problemas de calorimetría en vez de dar el equivalente en
agua del calorímetro, se determina su capacidad calorífica, con lo cual se
podría calcular fácilmente el calor absorbido por el mismo. Así si en un
calorímetro de capacidad calorífica 62,7 J/ºK, con 20g de agua a 25ºC, se
coloca un cuerpo de calor específico 2090J/kgK, a
75ºC, si la temperatura final es de 50ºC, dirás que la masa del cuerpo será en
gramos, aproximadamente:
a)10 b)11 c)12 d)13
Calor específico del cuerpo=2090J/kg.K. Calor específico del agua=4180J/kg.K
293. En un
calorímetro de capacidad calorífica despreciable , con 300g de agua a 20ºC, se
sumerge un bloque de hierro de 200g a
100ºC. Con los datos que te dan podrás asegurar que la temperatura final del
sistema una vez alcanzado el equilibrio será aproximadamente de:
a) 25ºC b) 30ºC c)35ºC d) 40ºC
DATOS:
Calor específico del hierro=449J/kg.K. Calor específico del agua=4180J/kg.K
294.
500g de plomo a 98ºC, se colocan en un calorímetro de hierro de 300g, que contiene
350g de agua a 20ºC.La temperatura final del sistema una vez alcanzado el
equilibrio es de 23ºC. Con los datos que te dan podrás asegurar que el calor
específico del plomo es en J/kgK aproximadamente de:
a) 110 b) 128 c) 310 d)
220
DATOS:
Calor específico del hierro=449J/kg.K. Calor específico del agua=4180J/kg.K
295. En un
calorímetro A, con capacidad calorífica 209J/K, hay 200g de agua a 25ºC. Se
sumerge en él un cuerpo de 15g a 350ªC.La temperatura de equilibrio es de
27,3ºC. Ese mismo cuerpo a 200ºC, se sumerge en otro calorímetro B con 100g de agua a 17ºC, alcanzándose una
temperatura de equilibrio de 19,8ºC. Con los datos que te dan podrás asegurar
que el calor específico del cuerpo en J/kg.K es:
a) 497 b) 369 c) 440 d)
390
Mientras que el
equivalente en agua del calorímetro B, será en kg:
a)
0,01 b) 0,02 c) 0,015 d)
0,025
DATOS:
Calor específico del agua=4180J/kg.K
296. Un calorímetro de capacidad calorífica
despreciable, contiene 20g de agua a 20ºC.Se sumerge en él 10g de un sólido a
100ºC, y un pequeño bloque de hielo a 0ºC. Al cabo de un tiempo se alcanza el
equilibrio, y la cantidad de agua pasó a 30g, quedando un poco de hielo. Con
los datos que te dan, podrás asegurar que el calor específico del sólido vale
en J/kg.K:
a)1530 b) 1375 c) 1450 d)
1628
DATOS: Calor de
fusión del hielo=3,3.105J/kg Calor específico del agua a 4180J/kg.K
297.Una placa
metálica cuadrada de lado 20cm y 1cm de espesor, a 20ºC, se sitúa en un calorímetro que
contiene 3kg de agua a 90ºC. Una vez alcanzado el equilibrio térmico y con los
datos que te dan, dirás que la longitud del lado de la placa en ese momento
será en centímetros de:
a)20,05 b) 20,005 c) 20,5 d)
21
Calor específico del metal =1672J/kg.K. Calor específico del agua=4180J/kg.K
Densidad de la placa metálica a 20ºC=8000kg/m3.
Coeficiente de dilatación lineal del metal=50.10-6 ºC-1
298. En un calorímetro , que contiene agua y hielo en equilibrio, se
hace pasar una corriente de vapor de agua a 100ºC y 1 atm, hasta que la mezcla
aumente su masa en 10g. Con los datos que te dan, dirás que la masa del hielo
que se ha fundido será en gramos aproximadamente de:
a)70 b)60 c)50 d)80
DATOS: Calor de
fusión del hielo=3,3.105J/kg
Calor de
vaporización del agua=2,26.106J/kg. Calor específico del agua a 4180J/kg.K
299. En un calorímetro con 5kg de agua a 20ºC, se echa un bloque de
hielo a -10ºC, y después se hace pasar 1g de vapor a 100ºC y 1 atmosfera, hasta
que todo el hielo funde, quedando todo en equilibrio en esta situación, Con los datos que te dan podrás asegurar que
la masa del bloque de hielo agregado en kg era:
a) 1 b)1,2 c) 1,5 d)2
DATOS: Calor de
fusión del hielo=3,3.105J/kg. Calor específico del hielo=2060J/kgK
Calor de
vaporización del agua=2,26.106J/kg. Calor específico del agua a 4180J/kg.K
300. Considera
la taza de café con cortado que tomas en una cafetería como un calorímetro de
capacidad calorífica despreciable. Si a 100g de café con leche a 20ºC, en una
cafetería se le agrega 2g de vapor de agua a 100ºC, y tomando el café con leche
como si fuera agua, dirás que la temperatura final del café con leche será en
ºC:
a) 25 b) 30 c) 32 d)
35
DATOS:
Calor de
vaporización del agua=2,26.106J/kg. Calor específico del agua a 4180J/kg.K
TERMODINÁMICA
15. Calorimetría
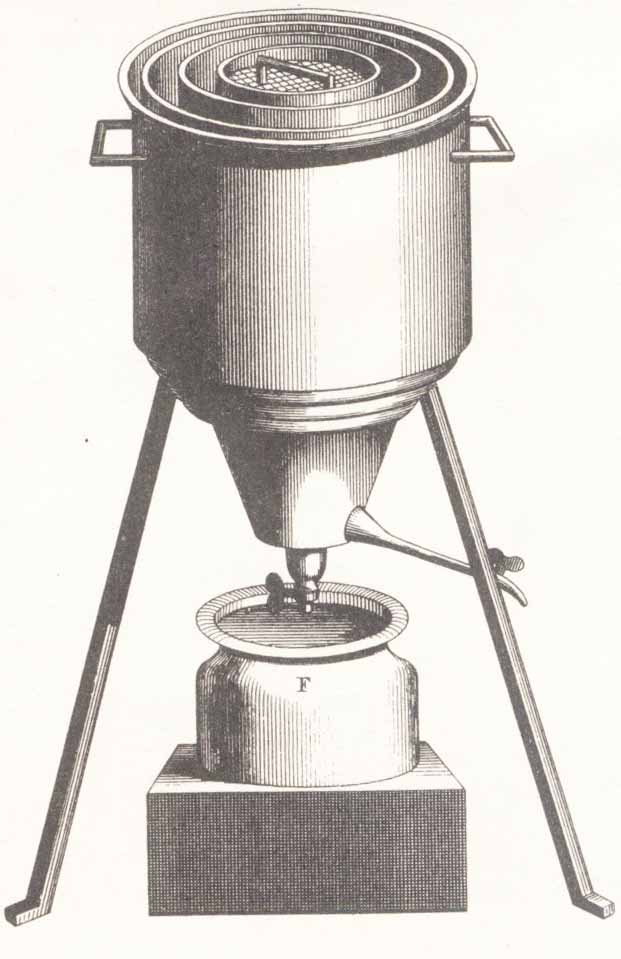
281*.En 1780,
Lavoisier y Laplace, publican la memoria “Sur la Chaleur”, en “Recueil de l’Academie”, y en ella describen el primer
calorímetro (nombre propuesto por Lavoisier), o calorímetro de hielo cuyo
dibujo se muestra. El calor liberado se medía por el hielo fundido, que se
recogía en el recipiente F, así hallaron que una onza de carbón al ser quemado “era capaz de fundir 6 libras y dos
onzas de hielo”. Aquí nació la
calorimetría como ciencia, y como sistema para medir el calor transferido entre
sustancias. Al narrar el experimento, Lavoisier escribe:”…se recoge el agua
producida al fundirse el hielo durante su enfriamiento, y se divide esta
cantidad de agua por el producto de la masa del cuerpo y el número de grados en
que su temperatura primitiva excedía del cero, el resultado será proporcional a
lo que los físicos ingleses han llamado calor específico”. Realmente lo que
se pudo calcular así sería:
a) El calor
de fusión del hielo b)
El calor específico del agua
c) La capacidad
calorífica del agua d) El
calor de combustión del carbón
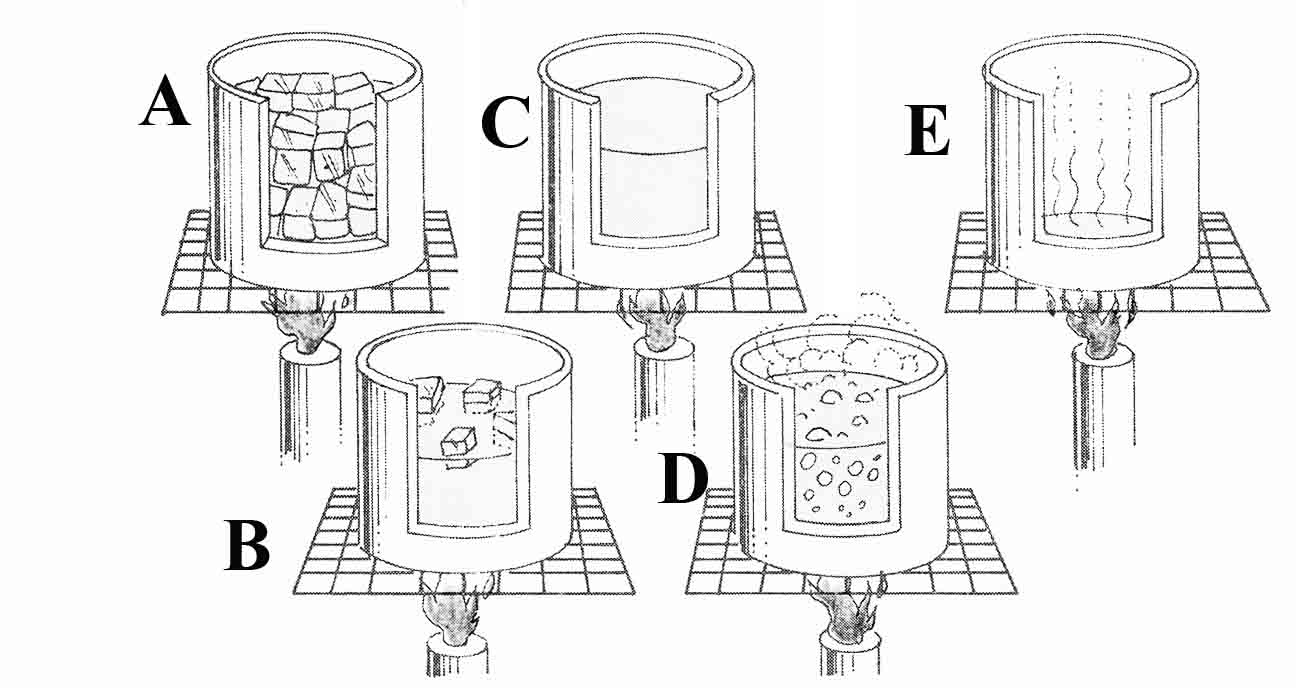
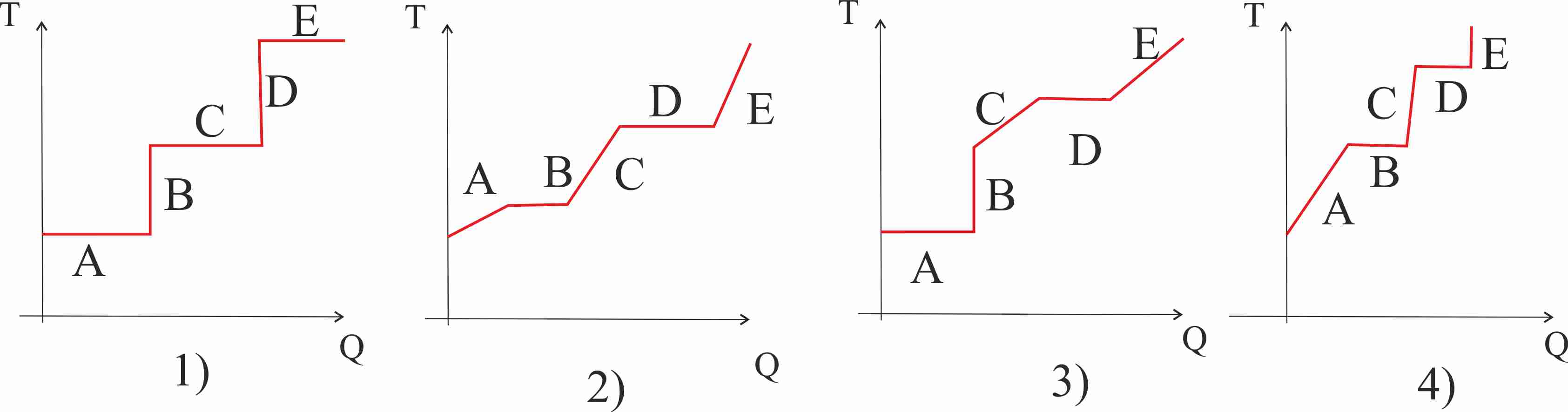
282. El dibujo representa las diferentes fases del calentamiento de
unos pequeños bloques de hielo (A), hasta que se convierte en vapor de agua(D),
la gráfica t/Q, que mejor representa el proceso , de todas las dadas: