ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TERMODINÁMICA 18. Transformaciones de estado
(continuación)
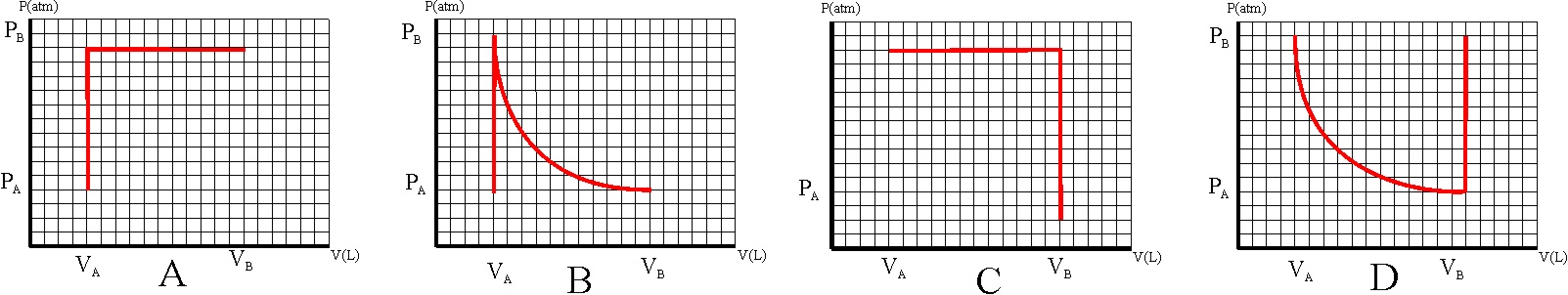
341.
De todos los procesos referidos a un mol
de un gas ideal, representados en un diagrama PV,

344*.
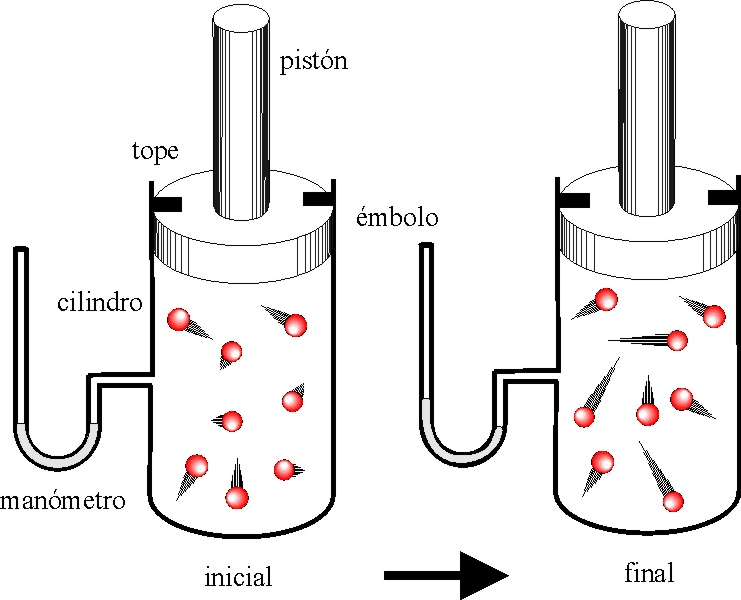
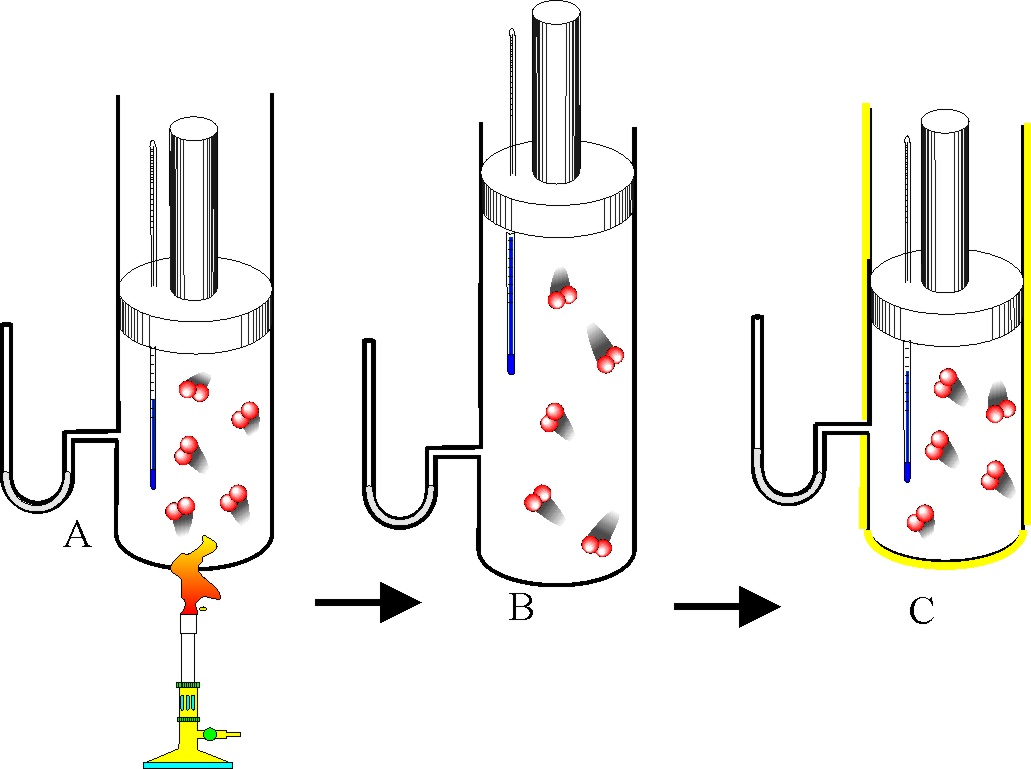
Si tenemos un gas monoatómico encerrado en un cilindro acoplado a un émbolo, y
el proceso evoluciona según se indica en la figura, la gráfica de las dadas que
mejor lo representa es la:
a)
A b) B c) C d) D
y
el sistema evoluciona:
a) aumentando la
presión b) aumentando la
velocidad de las moléculas
c) aumentando la
temperatura d) realizando un
trabajo
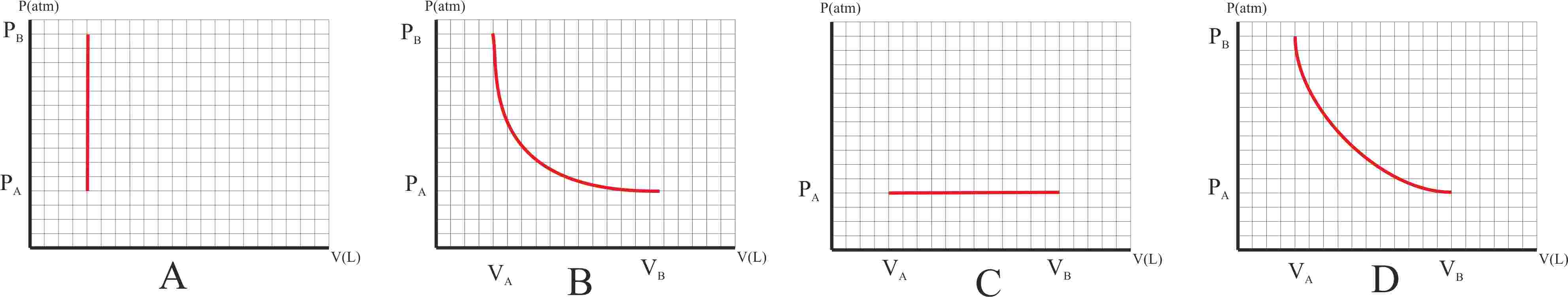
345.
De todos los gráficos dados en el test anterior, aquél que se desarrolla en el
menor intervalo de temperaturas, teniendo en cuenta que cada división
corresponde a una unidad dada, será en atm-L, de :
a) A b) B c) C d) D
R=0,082 atm.L K-1mol-1
346. Teniendo en cuenta el gráfico B de la adiabática del test 344, dirás que la variación de energía interna es aproximadamente:
a) -80J b)
80J c) -75J d)75J
CV=3R/2.
R=0,082 atm.L K-1mol-1; 1amt.L=8,31J.K-1.mol-1
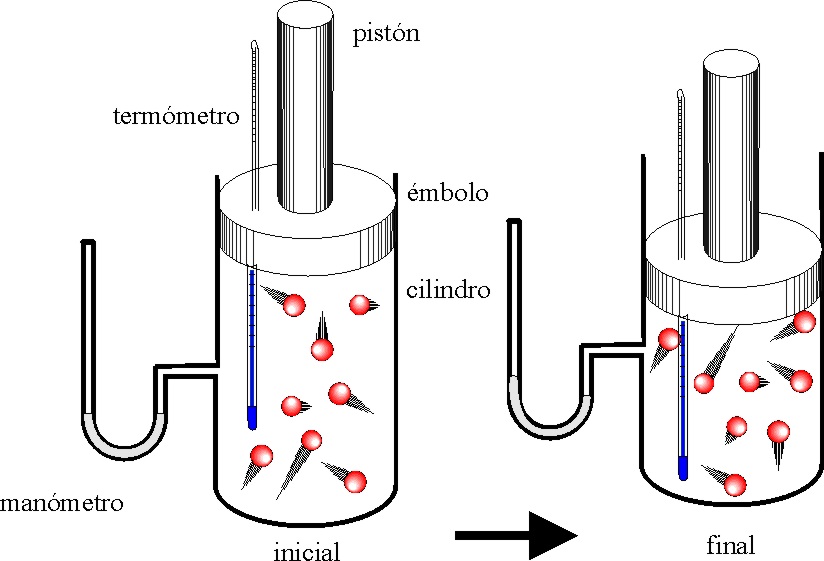
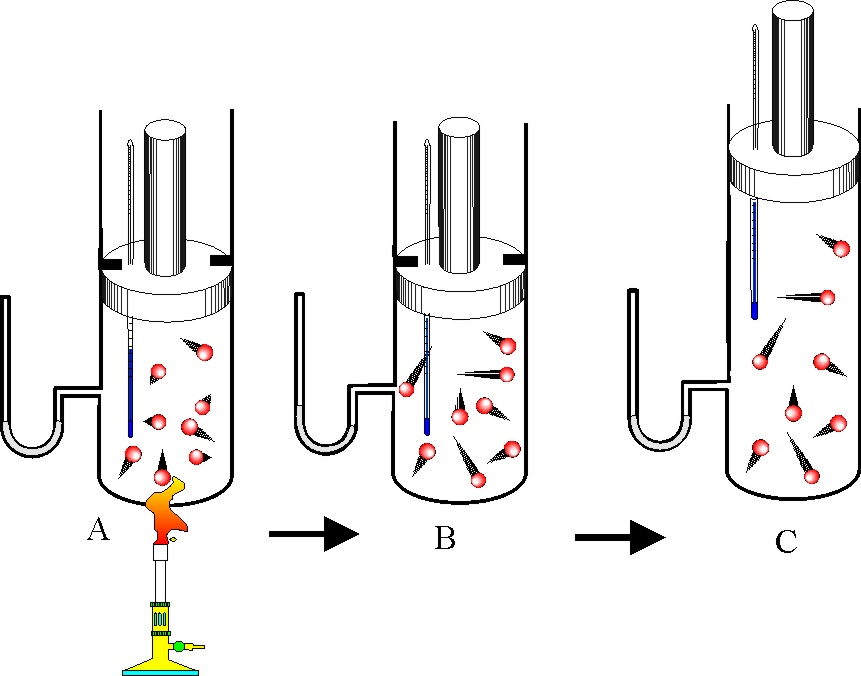
347.
Si tenemos un mol de un gas monoatómico encerrado en un cilindro acoplado a un
émbolo, y el proceso evoluciona según se indica en la figura la gráfica de las
dadas que lo representa es la:
a) A b) B c) C d)
D

y
la aplicación del primer principio de termodinámica a la evolución del sistema
exige que:
a) W=0 b) )U=0 c) )U=)H-P)V d) )U=-P)V
348.En
el test anterior, si el sistema evoluciona a presión constante, la variación de
energía interna no sólo depende de la variación de entalpía sino también de:
a) La variación
del número de moles gaseosos en la reacción
b) Del aumento
de la energía cinética de los reaccionantes
c) Del calor
transferido a los alrededores
d) Del trabajo
de expansión efectuado
349. El trabajo
que realiza el sistema en el proceso representado por el dibujo del test 347,
si cada división corresponde a unidad de las dadas, será en unidades del SI, de aproximadamente:
a)
-100 b)
-200 c)-300 d)-400
mientras aumento
de energía interna de las moléculas del gas en ese proceso es de:
a)
200 b) 400 c) 600 d)
800
CV=3R/2.
R=0,082 atm.L K-1mol-1; 1amt.L=8,31J.K-1.mol-1

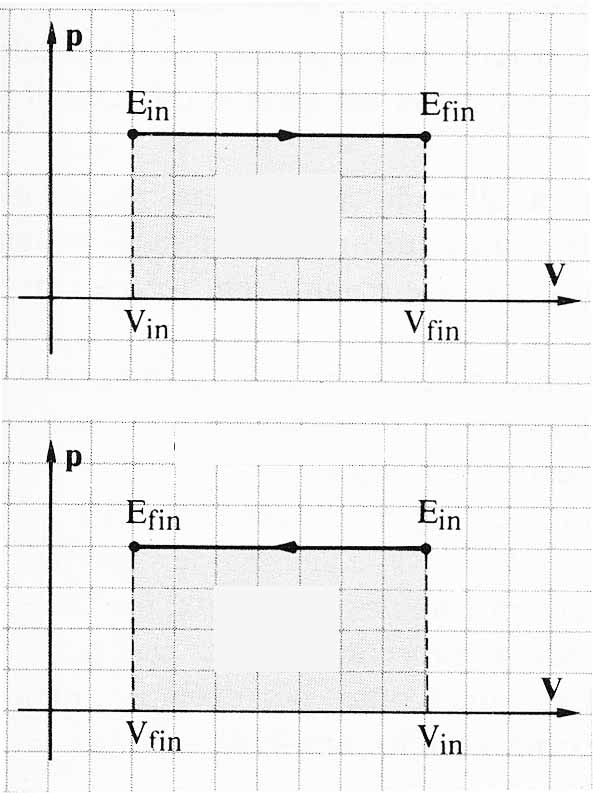
352*.La
diferencia en el trabajo representado en las dos gráfica está en que:
a)
En un caso es positivo y en el otro negativo
b)Serán
iguales porque abarcan la misma superficie
c)Serán
opuestos porque los estados iniciales y finales lo son
d)Serán
iguales porque P∆V, vale lo mismo
350.
Si tenemos un gas monoatómico encerrado en un cilindro acoplado a un émbolo, y
el proceso evoluciona según se indica en la figura, la gráfica de las dadas que
lo representa es:

la: a) A b) B c) C d) D
y el sistema
evoluciona de un estado a otro de forma que el primer principio aplicado a
dicho proceso vendría dado por: a) W=0 b) )U=0 c) )H=P)V d) )U=-P)V
351.
Según el proceso dado en el dibujo del test 350, y con los datos de su gráfica correcta
correspondiente dirás que aproximadamente el trabajo realizado sobre el sistema
será en julios de:
a) -750 b) 615 c)737 d) -615
DATOS: 1amt.L=8,31J.K-1.mol-1
DATOS: : 1amt.L=8,31J.K-1.mol-1

el que corresponde a una adiabática será: a)
El A b) El B c) El C d)
El D
342. De todos los procesos representados en el test anterior dirás que aquél en el que se desarrolla menor cantidad de trabajo es el :
a)A b)B c) C d) D
343.La
gráfica de una adiabática, se parece bastante a la de una isoterma en un
diagrama PV, sólo que aquella tiene una pendiente mayor que para un gas diatómico de comportamiento ideal será de :
a) 1 b) 1,2 c) 1,4 d)
2