Termoquímica 5. Ley
de Hess. Aplicaciones.
81.Germain Hess fue quizá uno de los termoquímicos más importantes y también más olvidados al haberse anticipado 50 años a los científicos de su generación. En 1840 enunció su ley experimental basada en la consideración de medidas calorimétricas efectuadas con rara precisión, en la neutralización del ácido sulfúrico con amoniaco, que comprobaron que el calor desarrollado en una reacción química sólo depende del estado inicial (reaccionantes) y del final (productos de la reacción) , y nunca de los procesos intermedios, todo ello antes de haberse enunciado el principio de conservación de la energía y la primera ley termodinámica. Naturalmente el calor medido siempre se hizo a presión constante, y por lo tanto sería lo que actualmente se considera:
a) Es equivalente al trabajo
b) Variación de entalpía
c) Es equivalente al calor
d) Es igual a la variación de energía interna
82.Para determinar el calor de formación de un compuesto químico hay primero que escribir la ecuación de su formación, circunstancia que a veces no resulta fácil. Si te dan estas 4 ecuaciones para la formación del sulfato de aluminio(sólido):
a) 3H2SO4(L)+ Al2O3(s)-3H2O
=
Al2(SO4)3(s)
b) 3H2SO4(L)+ 2Al(OH)3(L)-6H2O
= Al2(SO4)3(s)
c) 3S(s)+2Al(s)+6O2(g) =
Al2(SO4)3(s)
d) 3S(s)+2Al(s)+3O2(g) =
Al2(SO4)3(s)
dirás que sólo
es válida la : a) a b) b
c) c
d) d
83. Los aminoácidos son componentes fundamentales de nuestro organismo, a través de las proteínas. Uno de los aminoácidos mas conocidos es la histidina, fijador y protector del hierro(II) en nuestra sangre . Tiene de fórmula empírica C6H10N3O2, de las cuatro ecuaciones dadas :
a)
3C2(g) + 5H2(g)
+ 3N(g)+O2(g) = C6H10N3O2(s)
b)
3C2(s) + 5H2(g)
+ 3N2(g)+O2(g) = C6H10N3O2(s)
c) 6C(g) + 5H2(g) + 1,5N2(g)+2O(g) = C6H10N3O2(s)
d) 6C(s) + 5H2(g) + 1,5N2(g)+O2(g) = C6H10N3O2(s)
la que corresponde
a su formación sería la: a) a b)
b c) c d)
d
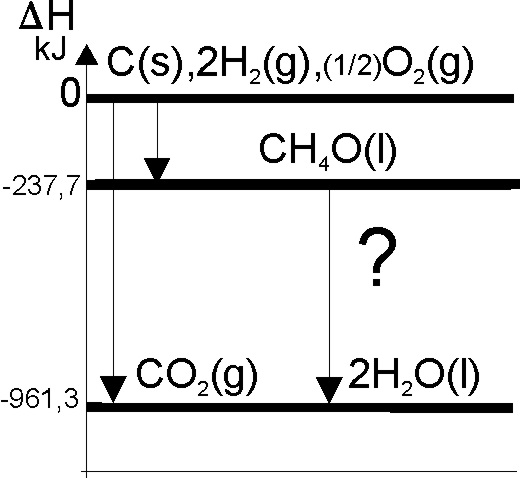
84*.El monóxido de carbono es un gas difícil de formar directamente, pues implicaría la combustión incompleta del carbón, y además es muy peligroso, al combinarse preferentemente al oxígeno con la hemoglobina de la sangre. Por eso aunque la ecuación termoquímica de su formación es:
C(s) + ½O2(g) = CO(g) + DHf0,
su entalpía de formación se podría
determinar indirectamente conociendo:
a) El
calor de combustión del dióxido de carbono y el del monóxido
b) El calor
de formación del dióxido de carbono y el de combustión del monóxido
c) El calor de formación del carbono y el de
formación del dióxido de carbono
d) El calor de combustión del carbono y el
de combustión del monóxido de carbono
85. Aunque el benceno se ha podido obtener catalíticamente directamente
a partir de sus elementos naturales, C(s) e H2(g), sin embargo
las condiciones no eran las óptimas para calcular Su calor de formación se
podría obtener aplicando la ley de Hess, si se conocen el calor de formación
del dióxido de carbono
![]() y del agua (L)
y del agua (L)
![]() , y el de combustión del benceno
, y el de combustión del benceno
![]() , porque su reacción de formación se puede conseguir a partir de la de combustión,
para ello bastará con:
, porque su reacción de formación se puede conseguir a partir de la de combustión,
para ello bastará con:
a)
![]() -6
-6
![]() -6
-6
![]()
b) 6
![]() -
-
![]() +6
+6
![]()
c) 6
![]() +3
+3
![]() -
-
![]()
d)
![]() -6
-6
![]() -3
-3
![]()
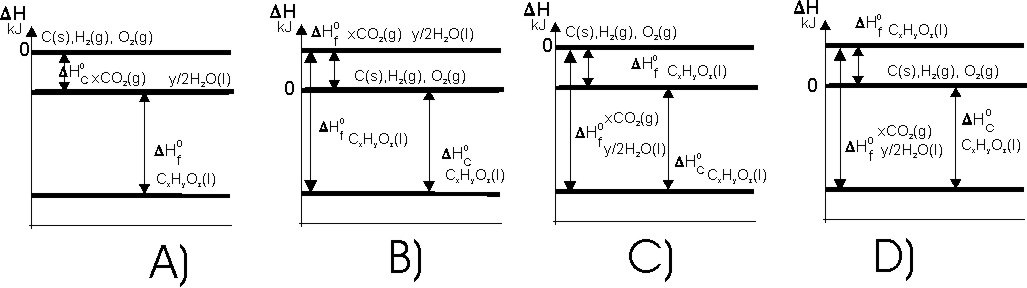
86. La generalización de la ley de Hess para calcular el calor de formación
de un compuesto orgánico CxHyOz, conociendo su entalpía de combustión
![]() , y las de formación
, y las de formación
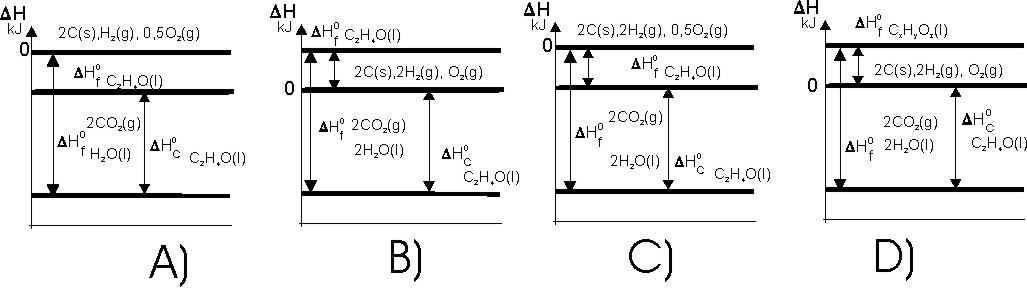
![]() y
y
![]() , implicaría:
, implicaría:
a) x
![]() +y
+y
![]() -
-
![]()
b)
![]() -( x
-( x
![]() +y
+y
![]() )
)
c)
![]() -( x
-( x
![]() +y/2
+y/2
![]() )
)
d) x
![]() +y/2
+y/2
![]() -
-
![]()
87. Aunque el ácido acético tiene un olor picante (vinagre), sin embargo, uno de sus derivados, el acetato de metilo huele muy bien. Este compuesto tiene una entalpía de combustión de
-1592 kJ.mol-1, de forma que aplicando la ley de Hess, y conociendo los de formación del dióxido de carbono y del agua líquida, respectivamente -394 y -282 kJ.mol-1, podrás asegurar que el calor de formación de este compuesto es en kJ.mol-1:
a) 128
b) 3620 c) -3620 d) -436
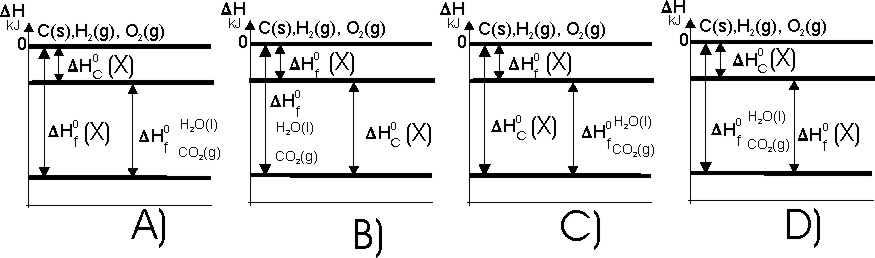
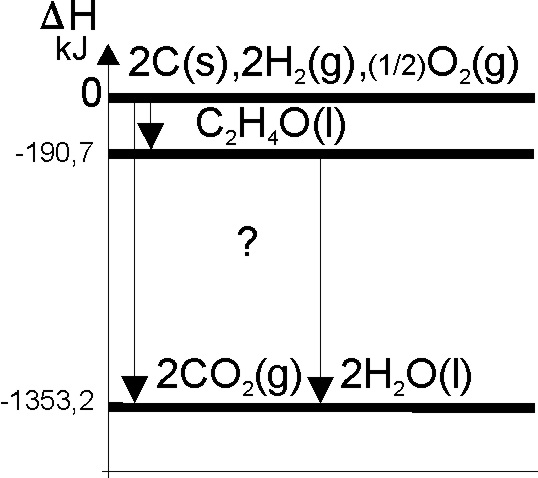
88. A partir de los primeros diagramas entálpicos de Ponchon y Savarit
en 1920, se utilizaron para visualizar y aclarar la ley de Hess, para ello
se fija el nivel 0 de la entalpía de de formación esto es el correspondiente
a los elementos en su estado desarrollan los primeros diagramas , y así mismo
el nivel de entalpía de los reaccionantes y productos de reacción, Así el
mas apropiado para un compuesto orgánico X
, con carbono, hidrógeno y oxígeno, de todos los dados: