ENSEÑANZA
DE LA FÍSICA Y LA QUÍMICA
sección:
TEST DE QUÍMICA CON ENUNCIADOS FORMATIVOS
CINÉTICA QUÍMICA 1
1*.Aunque ya en 1250, Alberto
el Grande (después San Alberto Magno), en su tratado de Alquimia, habla de
la afinidad entre las sustancias para motivar una reacción química, es Berthollet,
el que, terminando el siglo XVIII (1799), demuestra que la rapidez con que
se realiza una reacción química, depende
de la cantidad de sustancia reaccionante. Con ello había iniciado una nueva
rama de la química; la cinética. Rama que parte del concepto de velocidad
de reacción, que se medirá en:
a) Moles/segundo
b) Metros/segundo
c) Moles/litro.segundo
d) Molaridad/segundo
2*.En 1777, Wenzel demostró,
en reacciones de ácidos concentrados con el cobre que para disolver la misma cantidad de cobre, el
ácido con la mitad de concentración necesitaba el doble de tiempo, para la
misma superficie de reacción y temperatura. Este fue el primer hecho que vinculaba
el tiempo y la temperatura, con la cantidad de reaccionante una reacción química,
abriendo la puerta al concepto de velocidad de reacción. Por eso al principio
se consideró ésta como la cantidad de sustancia transformada por unidad de
volumen V y unidad de tiempo t. Por este motivo se la definió como:
a)
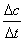 b)
b)
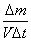 c)
c)
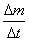 d)
d)
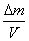
3.
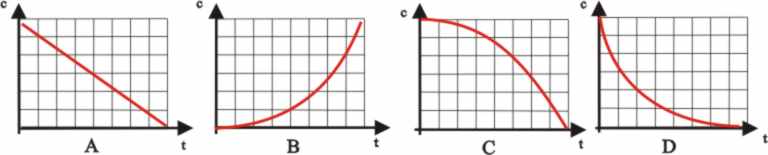
Dadas las gráficas concentración de
reaccionantes frente al tiempo para una determinada reacción química,
de
acuerdo con lo explicado la única posible de las cuatro es la:
a)
A b) B c) C d) D
5. Arrhenius, director
del Instituto Nobel de Física y Química, en Estocolmo, sugiere en 1889, que
las moléculas para que reaccionen deben colisionar, y para ello tendrán que
activarse, y la forma mejor es la absorción de calor, completando así el trabajo
efectuado por Van't Hoff, 5 años antes, en el cual había demostrado que la
velocidad de una reacción aproximadamente se duplica por cada 10ºC, de aumento
de temperatura. Por lo tanto si una determinada reacción se inicia con una
velocidad v, a 10ºC, si se calentara el sistema hasta 30ºC, su velocidad debería
ser:
a): 2V b) 4V c) 8V d)3V
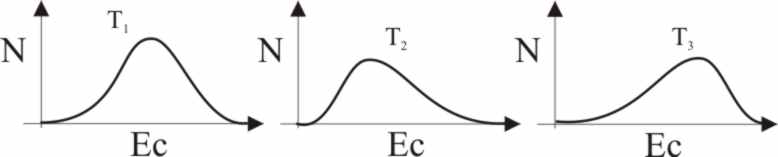
6.La distribución energética
de las moléculas, dado que se efectúa por colisión no es regular, sino
que es estadística y tiene forma de campana para una determinada temperatura
T, pero si ésta se modifica , se altera su forma, así si te dan las curvas
población molecular / energía cinética de un mismo sistema, para varias temperaturas
T1, T2 , y T3,
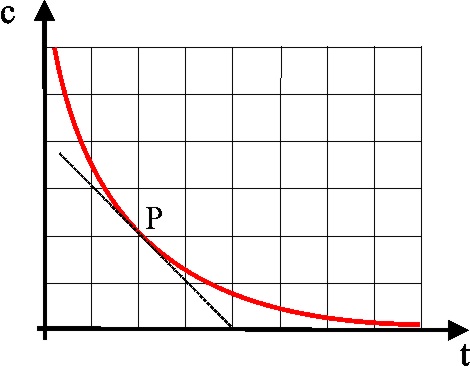
4. Si te dan la gráfica
de la variación de la concentración de los reaccionantes con el tiempo, y
se traza la tangente en un determinado punto P a dicha curva, la pendiente
de esta recta será:
a)
La velocidad media de la reacción
b)
La concentración en el instante dado, de los reaccionantes
c)
La velocidad en ese instante
d)
La concentración en ese instante de los productos
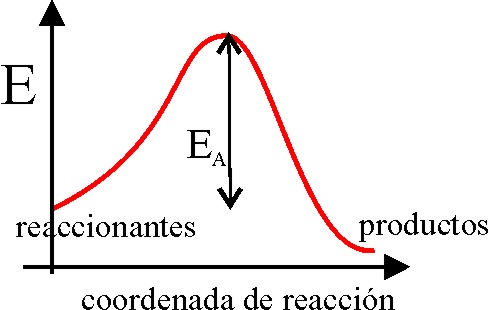
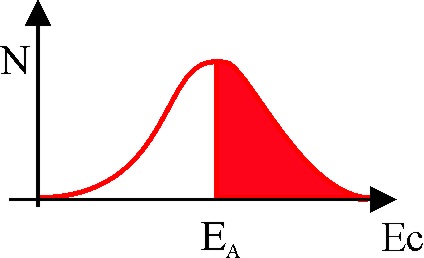
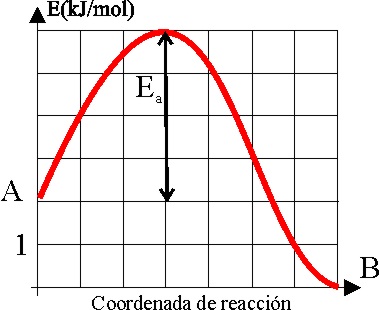
7. La energía de activación
sería la energía necesaria para que una molécula llegue a colisionar con otra,
paso necesario para que la reacción llegue a producirse. Si se estudia gráficamente
la variación energética de una hipotética reacción reaccionantes-estado intermedio de colisión-reaccionantes,
a través de la gráfica dada, dirás que la gráfica que mejor representa
la población molecular (en rojo) capaz de alcanzar dicho estado intermedio
activado es la:
a) A b) B c) C
d) D
dirás que:
a)
T1>T2
b) T1>T3
c) T1=T2
d) T3<T2
9. La molecularidad de
una reacción química se define como el número de moléculas que al colisionar
forman el estado intermedio de máxima energía. Por eso si el complejo activado
lo forma una única molécula que se descompone se llama unimolecular, si son
dos las que colisionan bimolecular y así sucesivamente, teniendo en cuenta
que las colisiones múltiples son muy poco frecuentes, la dada en el dibujo
entre moléculas diatómicas durante la reacción química, hace que dicha reacción
sea:
a)
Unimolecular b) Bimolecular
c)
Trimolecular d) Tetramolecular
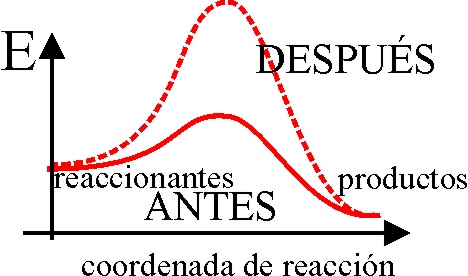
15. Así como
los catalizadores positivos o simplemente catalizadores disminuyen la energía
de activación, con lo cual existirán muchas mas moléculas capaces de colisionar,
los catalizadores negativos o inhibidores hacen la labor contraria, aumentando
la energía de activación. Si te dicen que
de la energía de activación experimenta la modificación que se aprecia
en el dibujo en determinada reacción, afirmarás que de todas las gráficas
de una población molecular gaseosa a una misma temperatura, en la cual se
observa las moléculas reaccionantes (en rojo), la más correcta será la:
a) A b) B c) C
d) D
16.En
1908, Arrhenius, Nobel de Química, y director del Instituto Nobel de Estocolmo,
escribía en un libro titulado "La formación de los mundos", que
la vida en la Tierra había comenzado con la llegada a través del espacio de
unas esporas, 20 años antes había descubierto que la velocidad específica de una reacción, que llamó constante
de la velocidad k, estaba relacionada con la temperatura a la que se producía
la misma a través de la expresión lnk=B/T + lnA, siendo A y B, dos constantes
para una misma reacción. Posteriormente, se hallaría que la velocidad específica
de una reacción k dependía de la frecuencia de las colisiones A, y del factor
de Boltzmann. Si se comparan ambas expresiones podrás deducir que la constante
B de la expresión de Arrhenius no sería más que:
a) La relación entre energía de activación y la constante de los gases con
el signo negativo
b) La relación entre la constante de los gases y la energía de activación
c) La relación entre constante de Boltzmann y la energía de activación
d) La frecuencia de las colisiones
17. En una tartera, suelen
cocerse los alimentos, a una temperatura sólo ligeramente superior a 100ºC.
En una olla a presión, el punto de ebullición de la disolución cocinada, podrá
alcanzar los 130ºC, por todo lo dicho anteriormente, el tiempo que tardará
en cocerse en estas circunstancias, será un número de veces menor, tal como:
a)
3 b) 9
c) 8 d) 16
18. Los alimentos que consumes,
como debes saber, llevan una serie de antioxidantes y conservantes, para prolongar
su duración, ya que el oxígeno del aire y la temperatura ambiente, son agentes
que rompen las uniones más débiles y los dobles enlaces produciendo su degradación.
Así el color tan rojo que tienen ciertas carnes, no es real, sino motivado
por el nitrito sódico. Dado que la temperatura acelera la velocidad de las
reacciones de degradación, se usan los frigoríficos que rebajan la temperatura
desde la ambiental de 25ºa -5ºC. En este caso el alimento mantenido así deberá
durar:
a)
4 veces más
b)
2 veces más
c)
8 veces más
d)
9 veces más
19. El butano, hidrocarburo saturado de 4 carbonos, recibe su
nombre, no porque but signifique 4, sino que deriva, como el de los otros
hidrocarburos inferiores, de un compuesto muy conocido; el ácido butírico,
extraído de la mantequilla. Butirum/i es mantequilla en latín. Pues bien,
el butano, se emplea como combustible en los quemadores y en las cocinas,
quemándose normalmente 2,24 litros/min. en las reacciones de combustión. Según
eso, la velocidad media de formación del dióxido de carbono será en condiciones
normales y moles/. minuto aproximadamente de:
a)
0,10 b) 0,20 c) 0,40 d) 0,50
20. En determinadas reacciones
en las que la colisión tiene que hacerse de tal forma que se rompan los enlaces
y se formen los nuevos enlaces casi simultáneamente, puede aunque las moléculas
posean energía de activación suficiente para llegar a colisionar, dicha colisión
no sea eficaz, o sea no de lugar a la reacción. En este caso se deberá introducir
en la expresión de la velocidad específica de la reacción un factor
p, llamado factor estérico que determine el número de colisiones eficaces,
del total de las producidas, quedando la expresión
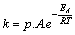 , en la que dicho factor:
, en la que dicho factor:
a)
Siempre será mayor que 1
b)
Dependerá de la orientación de la colisión
c)
Estará en función de la energía de activación
d) Solo
depende de la temperatura
8.
Si aumenta la temperatura en una reacción química, en estado gaseoso, siguiendo
la hipótesis de la colisión:
a)
Aumenta la
energía de activación
b)
Disminuye
la energía de activación
c)
Aumenta el
número de moléculas que poseen energía de activación
d)
Disminuye
el número de moléculas que poseen energía de activación
10*.En
1922, Linderman, sugirió que las moléculas adquirirían la energía de activación
necesaria para poder iniciar una reacción que no fue previamente calentada,
a través de colisiones Y que la fracción de las moléculas activadas que podrían
colisionar venía dado por una expresión llamada factor de Bolztmann. Si ese factor valiera 0,25
indicaría que:
a)
La cuarta parte de una población molecular sería
capaz de colisionar
b)
La energía de activación es la cuarta parte de
la energía media
c)
El 75% de la población molecular sería capaz de
colisionar
d)
La energía de activación es superior a la energía
media molecular
11. Boltzmann, profesor
austriaco de la universidad de Viena, aunque fue famoso por su interpretación
estadística de la entropía, adelantándose en algunos años a las ideas actuales,
su nombre, también va ligado a la cinética de las reacciones, al denominarse
factor de Bolztmann, la fracción de moléculas que poseen la energía de activación
necesaria para llegar a colisionar, ese factor actualmente viene dado por
la expresión e-EA/RT, siendo EA
la energía de activación, R la constante de los gases y T la temperatura absoluta.
Si la energía de activación fuera la indicada en la gráfica población molecular/energía
dirás que el factor de Boltzmann valdría:
a)
1 b) 0,5 c)
0,25 d) 0
12.
Dada la gráfica de la figura que representa la variación de energía en el
transcurso de la reacción química
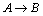 , que se realiza en fase gaseosa a 1000K, y conociendo que la constante de
los gases vale 8,14J K-1mol-1, dirás que el factor de
Bolztmann vale aproximadamente:
, que se realiza en fase gaseosa a 1000K, y conociendo que la constante de
los gases vale 8,14J K-1mol-1, dirás que el factor de
Bolztmann vale aproximadamente:
a) 0,01 b)
0,06
c) 0,6
d) 0,1
13*.Hace
más de mil años los chinos empleaban la palabra Tsoo Mei, que significa, "agente
de matrimonios", para referirse a sustancias que producían cambios en
otras que de otra forma no tendrían lugar. Los árabes, tenían en el mismo
sentido su Xerion Aiksir (que daría lugar al término elixir). Sólo en 1835,
Berzelius bautizaría dicha acción como
catálisis (del griego soltar), aunque la primera definición correcta de un
catalizador sería dada por Ostwald, 50 años más tarde .Como debes saber un
catalizar en una reacción química:
a) Dirige la reacción en un sentido determinado
b) Modifica el calor de reacción
c) Disminuye la energía de activación de la reacción
d) Aumenta la velocidad de reacción
14*. Siguiendo la teoría
de la colisión de Arrhenius, en la cual la reorganización de los enlaces,
para producir los productos de reacción deberá pasar por una colisión, y según
estudios posteriores, a través de ella, la formación de un compuesto intermedio
de máxima energía, dado que la mayor aproximación implica mayor repulsión
de las envolturas electrónicas. Para que este estado se alcance hace falta que:
a)
Se le suministre siempre energía de
activación
b)
Sólo se le suministre energía de activación a las reacciones endotérmicas
c)
Se oriente la colisión en un sentido preciso
d)
Se aumente la frecuencia de las colisiones
e)
Se empleen catalizadores
![]() b)
b)
![]() c)
c)
![]() d)
d)
![]()