ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
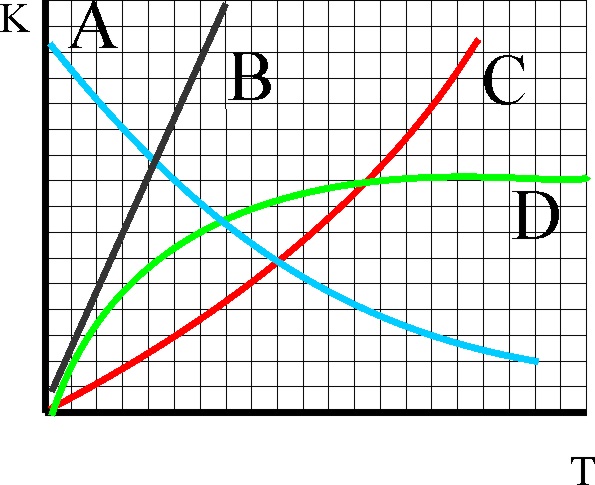
61. La gráfica dada, representa la variación de la constante de equilibrio de una
reacción muy exotérmica, que se produce cuando aumenta la temperatura. De
todas las dadas la única correcta deberá ser la:
a) A b) B c) C d)D
62. El sistema representado por la ecuación F +
G = H, estaba en equilibrio homogéneo. Al agregar un poco más de G, el equilibrio
se altera en el instante t. De los gráficos c/t dados dirás que el que mejor
nos indica lo ocurrido será el:

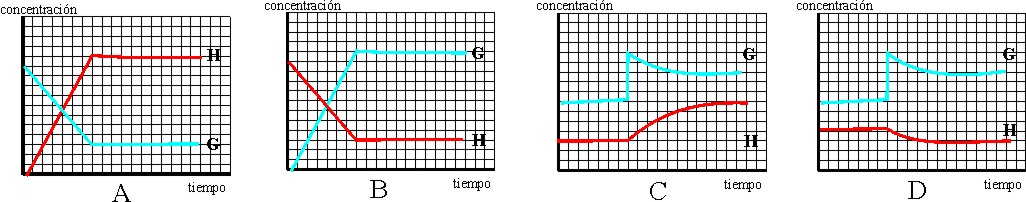
a) A b) B
c) C d)
D
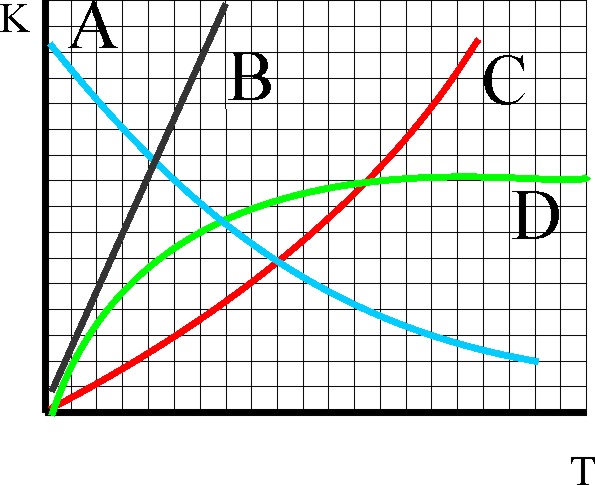
63. La gráfica dada, representa
la variación de la constante de equilibrio
de una reacción endotérmica, que se produce cuando aumenta la temperatura.
De todas las dadas la única correcta deberá ser la:
a) A b) B c) C d)D
64 La hidrogenación del eteno
para producir etano, es una reacción exotérmica, si a partir de un determinado
instante , se enfría el sistema de forma que su temperatura disminuye, la
gráfica que mejor representa dicho fenómeno hasta que se restablece el equilibrio
es la
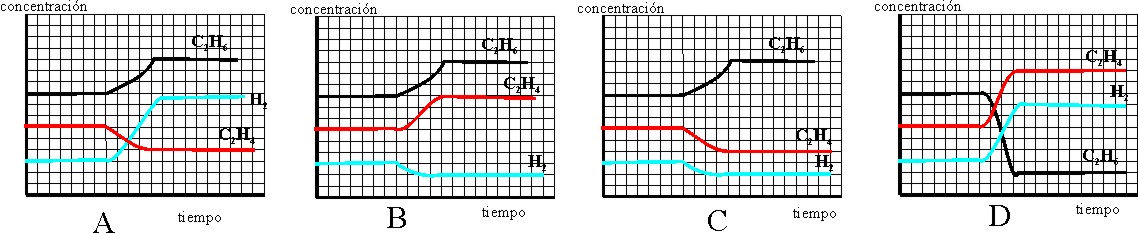
65*.Aunque desde hace muchos siglos
se conocía la acción de una serie de sustancias para ayudar a la realización
de una reacción química, el concepto de catalizador sólo fue introducido por
Berzelius en 1835, tomándolo del griego "soltar". Por eso el catalizador
es una sustancia que :
a) Suelta los enlaces de los reaccionantes
b) Aumenta la velocidad de reacción
c) Modifica la velocidad de reacción
d) Altera la energía de activación
e) Orienta los reaccionantes para facilitar su colisión
66*.Aunque determinados insectos
lo producen en su metabolismo, el ácido fórmico fue obtenido en el laboratorio
por primera vez en 1754, por Margraff, y en su descomposición en agua y monóxido
de carbono se emplea el ácido sulfúrico cuya masa se mantiene constante, por
lo que dirás que éste :
a ) No interviene en la reacción
b) Es un catalizador
c) Absorbe energía
d) Aumenta la energía de activación
e) Es un deshidratante
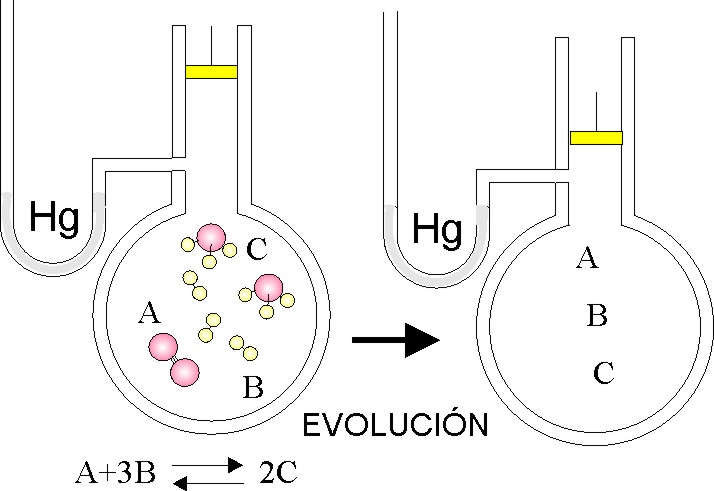
67.El dibujo representa el sistema gaseoso en equilibrio dado, si se actúa sobre él tal como se representa, dirás que cuando se restablece dicho equilibrio, la concentración de:
a) A aumenta
b) B disminuye
c) C aumenta
d) C disminuye
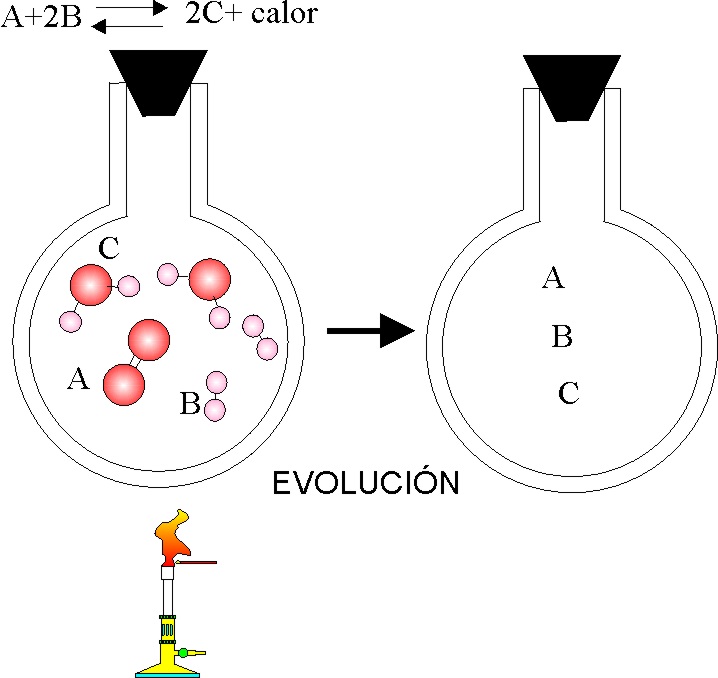
68. El dibujo representa el sistema gaseoso en equilibrio dado, si se actúa sobre él tal como se representa, dirás que cuando se restablece dicho equilibrio, la concentración de:
a) A aumenta
b) B disminuye
c) C aumenta
d) C disminuye
69.La molécula de bromo tiene una energía de enlace relativamente pequeña, por eso se puede disociar en sus átomos por encima de los 1000ºC. Si su grado de disociación en estas circunstancias es del 0,3%, y dispones de 16g de bromo en un recipiente de medio litro de capacidad, dirás que al cabo de cierto tiempo:
a) La presión sobre las paredes del recipiente es de 20,93 atm.
b) Kc valdría 7,22
c) Kp sería 0,00075
d) La cantidad de bromo atómico formada sería de 0,0024 moles
DATOS. R=0,082 atm. LK-1 mol-1,
Br=80
70. El cloruro de yodo, es un líquido rojizo que se disuelve en el agua, produciendo yodo y ácido yódico, pero que al ser calentado se disocia formando yodo y cloro moleculares. Si te dicen que la constante de este equilibrio Kc vale 0,11, a 800ºC, asegurarás que cuando se le somete a esta temperatura , su porcentaje de disociación es aproximadamente del:
a) 10% b) 20% c) 30% d) 40%
71. Las llamas azules que se forman cuando arde el monóxido de carbono, se originan cuando una corriente de dióxido pasa a través de carbono incandescente. Esto es lo que ocurre en la parte alta de un alto horno, y dado que es un importante agente reductor, reduce los óxidos metálicos hasta el metal.
Realmente es una reacción de equilibrio cuya constante Kp a 900ºC, vale 1,25. Según eso podrás asegurar que si la presión a que está el proceso es de 2,3 atm, el % de CO2 que permanece en el equilibrio es aproximadamente del:
a) 20% b) 30% c) 40% d)50%
72.Razone si son correctas o incorrectas las siguientes afirmaciones:
a) En una reacción química puede ser )G=0
b) )G=0 es independiente de la temperatura
c) La reacción es espontánea si )G>0
d) La reacción es muy rápida si )G<0
73*. Todo el mundo emplea el gas natural y su componente principal, el metano, en reacciones de combustión, sin embargo lo que no sepas, es que si se calienta excesivamente de descompone en carbono e hidrógeno, en un equilibrio heterogéneo. Si a 1000ºC y 1 atmósfera, existe un 60% de metano en dicho equilibrio, dirás que
a) El grado de disociación es del 25%
b) Kp valdría 0,27
c) La fracción molar del hidrógeno en el equilibrio es de 0,6
d) Si la presión disminuye diez veces, el grado de disociación se duplica
74*. Aunque posiblemente no lo creas, el trióxido de azufre, a diferencia del dióxido que es un gas, es un sólido por debajo de 16ºC, sin embargo al calentar ligeramente, pasa rápidamente a líquido y por encima de los 50º ya es gas. Se obtiene catalizando la oxigenación del dióxido con platino, pero dicha reacción es de equilibrio. Si a 1100K, Kp vale 0,13, y la fracción molar del SO3 en el equilibrio es 0,5, cuando partes de 2 moles de dióxido de azufre y 1 mol de oxígeno, dirás que:
a) Kc vale 17,1 b) Los moles de oxígeno en el equilibrio son 0,4
c) La presión a que está sometido el recipiente es de 104 atm.
d) La presión parcial que ejerce el dióxido de azufre en el equilibrio es de 34,3 atm
DATOS. R=0,082
atm. LK-1 mol-1
75. Se indica que la reacción en
fase gaseosa A+2B6C, sólo depende de la concentración de A, de tal manera que
si se duplica dicha concentración, la velocidad de reacción también se duplica.
En función de esto asegurarás que:
a) La concentración de B es la que varía mas rápidamente
b)
La reacción es de tercer orden
c)
Las unidades de la constante cinética son s-1
d)
Si el volumen disminuye la velocidad aumenta
76*.El término radical fue creado por Woehler en 1832, para designar aquellos fragmentos de moléculas que se combinaban rápidamente en una reacción química. Cuando la iniciación de una reacción se efectúa por rotura de enlaces covalentes, quedando cada átomo con el electrón que antes compartía, tenemos un mecanismo de radicales.Van a surgir fundamentalmente en las :
a) Reacciones fotoquímicas
b) Fotólisis c) Descomposiciones de los halógenos
d) Reacciones iniciadas con peróxidos
e) Sustituciones de hidrógenos de los hidrocarburos
77*. Si repasas la cinética química y el equilibrio químico asegurarás que:
a) La presencia de un catalizador afecta a la energía de activación de una reacción química pero no a la constante de equilibrio
b)
En una reacción con
![]() ,la energía de activación del proceso directo(EA) es siempre menor
que la del proceso inverso
,la energía de activación del proceso directo(EA) es siempre menor
que la del proceso inverso
c) Una vez alcanzado el equilibrio en la reacción del apartado anterior, un aumento de temperatura desplaza el equilibrio hacia los reactivos
d) Alcanzado el equilibrio las constantes cinéticas de los procesos directos e inversos son siempre iguales
78*. Teniendo en cuenta que a 60ºC los calores de formación
del NO2(g) y del N2O4(g)
son respectivamente 51,29 y 97,98 kJ/mol, dirás que :
a)
El calor de reacción de N2O4(g)«2NO2(g) a 60ºC es 4,6 kJ/mol
b)
Kp sabiendo que está disociado un 60% a 60ºC y 1 atm
es 2,25
c)
Kc vale 2,25
d)
En el equilibrio sólo permanece el 25% de tetraóxido
de dinitrógeno
DATOS. R=8,31J.K-1
mol-1
79. Considérese la siguiente tabla cuyos datos están obtenidos
a 1 atm y 298K:
| |
DHf0(kJ/mol) |
DS0(J/Kmol) |
| O2(g) |
0 |
204,82 |
| NO(g) |
90,29 |
210,25 |
| NO2(g) |
33,82 |
240,35 |
Para la reacción: NO(g)
+½O2(g)®NO2(g), dirás que :
a)
La variación DG0(kJ/mol) es -35 kJ.mol-1
b)
Si DH y DS son constantes con la
Tª. la de equilibrio es 779K
c)
Si la temperatura tomara un valor mayor que el obtenido
en b la reacción se pararía
d)
Kp para la reacción, valdría 26,93.
DATOS. R=8,31J.K-1
mol-1
80. Considérese la siguiente tabla cuyos datos están obtenidos
a 1 atm y 298K:
| |
DGf0(kJ/mol) |
DS0(J/Kmol) |
| O2(g) |
0 |
204,82 |
| Mn2O3(s) |
-887,41 |
93,38 |
| Mn3O4(s) |
-1279,08 |
148,39 |
Para la reacción: Mn2O3(s)« Mn3O4(s) +½O2(g), dirás
que :
a) La reacción es
exotérmica
b)
Kp vale
c) La P del oxígeno en el equilibrio es
d) La Tª a la cual Kp tiene un valor de 0,45 es
DATOS. R=8,31J.K-1
mol-1