Equilibrio
Ácido-base 8
141. Las sales sódicas y cálcicas del ácido propiónico, tienen bastante uso comercial como fungicidas, sobre todo en las industrias de panadería y lácteos para inhibir la aparición de mohos, sin embargo ambas sales requieren cierta acidez del medio para su mejor utilización. Si se mezcla 30mL de ácido propanoico 0,015M con 20mL de propanoato sódico 0,5M, el pH de la mezcla será aproximadamente:
a) 5,2 b) 6 c) 6,2
d) 5,7
Dato:pK=4,87
142.El sistema regulador del pH sanguíneo más usado es el hidrogenocarbonato‑carbonato, no en balde el hombre es una verdadera fábrica de ácido carbónico; casi un kilogramo por día. Sin embargo las propiedades amortiguadoras, se deben más al dióxido de carbono que al propio carbónico. Si a 15 ml.de una solución 0,1M de hidróxido sódico se añadiera a 50 ml.de disolución amortiguadora en la que la concentración de hidrógeno carbonato fuera 0,3M y la del CO2 disuelto fuera 0,15M. el pH sería aproximadamente:
a) 6,5 b) 6,7 c)
6,9 d) 7,1
Mientras que la variación de pH sería de:
a) 0,10 b) 0,12 c) 0,14 d) 0,16
Datos: Ka=4,2.10‑7.
143.La ecuación de Henderson-Hasselbalch
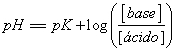 , puede emplearse para todo tipo de neutralizaciones. Así si cuando reacciona
50 mL de ácido acético 0,1 con 30 mL de hidróxido sódico 0,1M. Dirás que el
pH final es:
, puede emplearse para todo tipo de neutralizaciones. Así si cuando reacciona
50 mL de ácido acético 0,1 con 30 mL de hidróxido sódico 0,1M. Dirás que el
pH final es:
a) 4,9 b) 4,5 c) 5,4 d)
5
Dato: Ka=1,8.10-5
144.En el verano de 1832, comenzó lo que Berzelius llamó “La aurora de un nuevo día en la química orgánica”, con el trabajo desarrollado por Liebig y Wöhler sobre el radical del ácido benzoico. Este ácido se conocía desde 1590, pues había sido extraído de la flor del benjui, por sublimación al ser calentado, cristalizando en agujas blancas, y su nombre procede del árabe lubenyawi (incienso de Java), por su olor y origen. Es un ácido débil y cuando se mezclan 0,5L de ácido benzoico 0,03M con 0,5L de NaOH 0,01M, dirás que el pH final será aproximadamente :
a) 4 b) 3,9 c) 4,2 d) 4,1
Dato: pK del ácido benzoico 4,2.
145. Para que el pH de una disolución de ácido acético 0,100M sea 4,2 habrás que añadirle a 200mL de disolución del mismo un número de gramos de acetato sódico de:
a) 0,50 b) 0,49 c) 0,45 d)
0,46
Dato: pKa=4,75.
Masas atómicas: C=12, O=16, Na=23
146.Si a medio litro de ácido acético (densidad=1 g/cm3), que contiene el 4% de ácido en peso, se le agregan 2,8 gramos de potasa, el pH resultante será:
a) 4,0 b) 4,1 c) 3,9 d) 3,8
Dato: Ka=1,8.10-5. K=39, O=16, H=1.
147. La hidrólisis es la reacción
reversible de la neutralización, disociación de una sal por acción del agua.
Por lo tanto habrá que partir de la naturaleza de la sal AB, para estudiarla,
en función de su procedencia. Teniendo que en el agua todas las sales se disocian
completamente
![]() , y los ácidos y bases fuertes regenerados también se disocian así. Siempre
dominará el carácter fuerte que exista, y el pH resultante será ácido o base
según dicho carácter. Así si te dicen de ordenar de menor a mayor pH las siguientes
sales sódicas en igual concentración numeradas:
, y los ácidos y bases fuertes regenerados también se disocian así. Siempre
dominará el carácter fuerte que exista, y el pH resultante será ácido o base
según dicho carácter. Así si te dicen de ordenar de menor a mayor pH las siguientes
sales sódicas en igual concentración numeradas:
1. Clorito sódico 2.
Formiato sódico 3. Fluoruro sódico
Dirás que el pH de:
a) 1<2<3 b) 2<1<3 c) 1<3<2 d)
3<1<2
Datos Ka(HF)=10-3; Ka(HClO2)=10-2;
Ka(HCOOH)=10-4;
148*.Se preparan disoluciones acuosas de igual concentración de HCl, NaCl, NH4Cl y NaOH.
Con los datos de que dispones podrás asegurar que:
a) La disolución que tendrá mayor pH, será la de hidróxido sódico
b) La disolución que tendrá menor pH, será
la de ácido clorhídrico
c) La disolución es neutra, es la de cloruro
amónico?
d) La disolución que no cambiará su pH al diluirla
es la de cloruro sódico
Dato.
Ka NH4+
= 10–9
149.Al mezclar 50cm3 de disolución 0,5M de ácido fluorhídrico y 50cm3 de disolución 0,5M de hidróxido sódico la disolución resultante es:
a) Ácida
b) Neutra c) Básica
d) Con pH menor de 7
150.Se tienen tres disoluciones acuosas, de sulfato potásico, de cloruro amónico, de acetato sódico con igual concentración. La de menor pH será la de:
a) Sulfato potásico b) Cloruro amónico
c) Acetato sódico
151. Cuando una sal se descompone en el agua, regenerando el ácido y la base de la que procede la constante de este equilibrio se denomina:
a) Constante de equilibrio
de la sal b) Constante
de hidrólisis
c) Constante ácida
de la sal d)
Constante básica de la sal
152. La constante de hidrólisis depende siempre de
a) El producto iónico del agua
b) La constante ácida
c) La constante básica d)
El producto iónico del agua y la constante de la parte débil de la sal
153*. Para que una sal de un ácido débil tenga un pH neutro hace falta que:
a) Esté muy diluida
b) Se forme con una base débil cuya Kb=Ka
c) No se disocie en el agua
d) Su concentración sea 1M
Dato: KW=10-14
154*. Para que una sal de una base débil tenga un pH=7, hace falta que:
a) Esté muy diluida
b) Se forme con una ácido débil cuya Ka=Kb
c) No se disocie en el agua
d) Su concentración sea 1M
Dato: KW=10-14
155.A partir e los valores de Ka suministrados, se puede ordenar de menor a mayor el pH de disoluciones acuosas de las siguientes sales
1.NaF 2. NH4CN 3. NH4F 4. NH4Cl
de esta
forma:
a) 1<2<3<4 b) 2<4<1<3 c) 4<3<2<1 d) 4<2<3<1
Datos: Ka(HCN)= 6,2.10-10;
Ka(HF)=6,7.10-4; Ka(NH4+)=5,5,10-10
, KW=10-14
156. En el Tratado Elemental de
Química de Lavoisier, se puede leer la lista completa de las combinaciones
del radical acetoso, con el álcali volátil, que antiguamente se conocía como
espíritu de Mendererus o agua de Menderer, por haber sido obtenida por este
alquimista a partir del asta de ciervo. Se está hablando de lo que se conoce
actualmente como acetato amónico; una sal de ácido y base débil. Pues bien,
el pH de una disolución de acetato amónico 0,15M, será:
a) 6 b) 6,5 c) 7 d) 7,5
Dato: KW=10-14 Ka=1,81.10-5 Kb=1,8.10-5
157.El color rojo de las carnes
que se observan con envidia en los
supermercados y carnicerías, no es natural pues se debe al nitrito sódico
que se le echa para conservarlas. El nitrito forma con la carne, óxido nítrico
NO, que reacciona con la hemoglobina, produciendo
la nitrosohemoglobina, pigmento responsable de aquel buen color. Sin
embargo a su vez también forma con los terminales proteínicos, nitrosoaminas,
productos eminentemente cancerígenos. Si la constante de ionización del ácido
nitroso a 25ºC es 4,1.10‑4,
el pH de una disolución 0,01N de nitrito sódico será
a) 7
b) 7,3 c) 7,5 d) 7,7
Kw=10-14. MASAS ATOMICAS:N=14/O=16/H=1/Na=23.
158.El cloruro amónico es usado en medicina como expectorante e incluso en tratamientos con determinados antibióticos que deben actuar sobre el riñón, dado que un pH bajo favorece su actividad. La solubilidad del cloruro amónico en el agua es 41 g/100 mL. a temperatura ambiente. El pH de una solución saturada de cloruro amónico será:
a) 4,5 b) 4 c) 3,5 d) 3
Kb del amoniaco=1,8.10‑5. Kw=10-14
. MASAS ATÓMICAS:Cl=35,5/N=14/H=1.
159.Si se hacen pasar 60cm3
de amoniaco a 27ºC y 700 mmHg, a través de 250 cm3de una disolución
de ácido clorhídrico 0,1N ; el pH de
la disolución obtenida supuesta totalmente ionizada será de
a) 1
b) 1,5 c) 2 d) 2,5
Datos: Kb del amoniaco=1,8.10‑5.
Kw=10-14 .R=0,082
atm.L.K-1.mol-1
160. Se pretende preparar 1L de una disolución reguladora de pH=8,5, y esta vez se parte de 5,35g de cloruro amónico, y la cantidad necesaria de amoniaco (Ka(NH4+)=5,5,10-10) que será en gramos aproximadamente:
a) 0,02 b) 2,00 c) 0,002 d) 0,002