
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA


Redox 3
41*. Uno de los experimentos que puedes hacer perfectamente en el laboratorio y que te permitiría recordar el proceso de la pila Daniell, sería sumergir una lámina o chapa de cinc en un vaso de precipitados que contuviera una disolución de sulfato de cobre (II), tal como se muestra. Al cabo de cierto tiempo obtendrías una disolución A’, y una lámina B con una parte sumergida B’ de las que podrías decir que:
a) A’ es una disolución de sulfato
de cinc
b) A’ es una disolución de sulfato
de cobre (II), con menor concentración de la inicial y algo de sulfato de
cinc
c) B’ es una lámina de cinc cubierta
de un ligero polvo de cobre en la parte sumergida
d) El Cu 2+, tomó 2 electrones oxidándose
a Cu
e) La reacción redox que se realizó
espontáneamente sería CuSO4 + Zn -> ZnSO4 + Cu


42. En el test anterior, la lámina B de cinc, una vez limpia queda en su parte sumergida como se observa en la figura disminuyendo en una cantidad:
a) Igual a la de cobre depositado
b) tal que el número de moles en que disminuye es igual al de moles de
cobre que se depositaron
c) Mayor a la del cobre depositado
d) Doble de la del cobre depositado

43. En la foto se muestra la reacción entre el ácido sulfúrico diluido y una plancha de cinc, produciéndose como se aprecia grandes burbujas de hidrógeno. Es una reacción redox característica en la cual actúa como oxidante:
a) El ácido sulfúrico b) El H+
c) El cinc d)
El agua
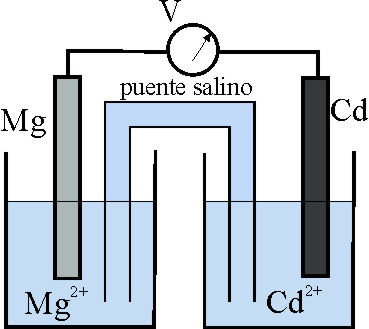
45. El esquema dado, corresponde al estado inicial de una pila Mg/Cd.
Teniendo en cuenta que:
E0 Mg2+/Mg = -2,37V, y el E0 Cd2+/Cd es -0,40V
los procesos que van a tener lugar,
según indican las flechas ocasio-narán al cabo de cierto tiempo un estado
de las planchas metálicas dado por el montaje:
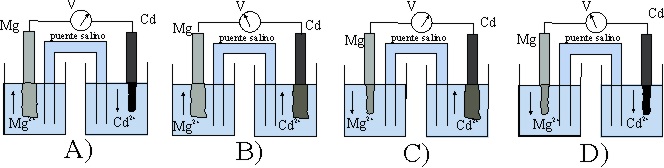
de todos los dados el correcto será el:
a) A b) B
c) C d) D
46. En la pila anterior:
a) El ánodo será el electrodo Cd2+/Cd
b) Los electrones irán del Mg al Cd
c) La intensidad de la corriente formada por el hilo metálico externo
irá de Mg a Cd
d) El cátodo será el electrodo Mg2+/Mg
47. El esquema simbólico de la pila anterior de todos los dados:

Será el a) A b) B c) C d) D
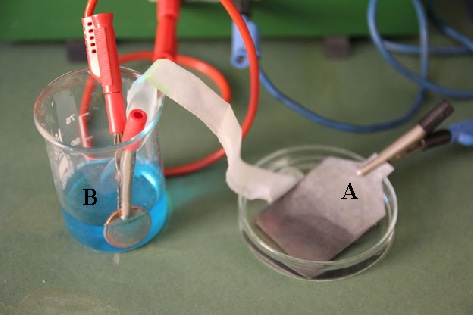
48. En la fotografía dada, se representa una pila formada por una lámina de cinc, en una disolución de sulfato de cinc, y una moneda de cobre en otra de sulfato de cobre (II). Conocidos los potenciales normales de reducción dirás que:
a) A es el cátodo
b) En B está el oxidante
c) El Cu de la moneda pierde electrones
d) El cable azul está mal conectado según el
convenio de colores
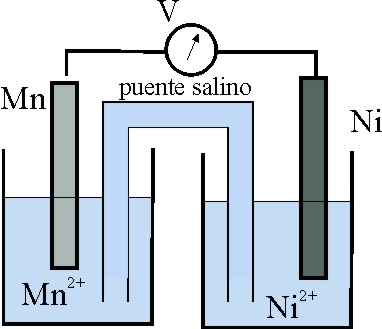
49. El esquema dado, corresponde al estado inicial de una pila Mn/Ni.
Teniendo en cuenta que:
E0 Mn2+/Mn= -1,18V, y el E0 Ni2+/Ni es -0,25V
los procesos que van a tener lugar, según indican las flechas ocasio-narán al cabo de cierto tiempo un estado de las planchas metálicas dado por el montaje:
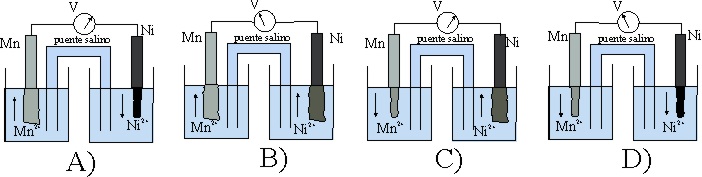
de todos los dados, el correcto será el:
a) A
b) B
c) C
d) D
50*. En la pila anterior:
a) El cátodo será el electrodo Ni2+/Ni
b) Los electrones irán del Mn al Ni2+
c) La intensidad de la corriente formada por el hilo metálico externo
irá de Mn a Ni
d) El voltímetro marcará inicialmente en condiciones normales 0,93V
51. El esquema simbólico de la pila anterior de todos los dados :
a)
![]() b)
b)
![]()
c)
![]() d)
d)
![]()
Será el a) A
b)B c) C d) D

52. En la fotografía dada, se representa una pila formada por una sortija de plata B, en una disolución de nitrato de plata, y una moneda de una aleación de níquel en otra de sulfato de níquel(II). Conocidos los potenciales normales de reducción dirás que:
a) A es el cátodo
b) En B está el oxidante
c) La plata de la moneda gana electrones
d) La diferencia de potencial que marcaría
un voltímetro sería superior a 2V
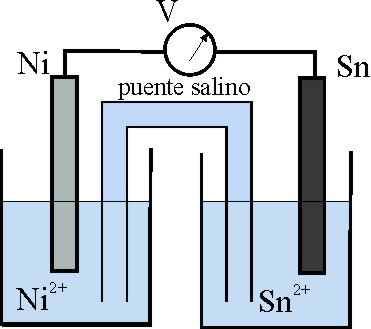
53. El esquema dado, corresponde al estado inicial de una pila Sn/Ni.
Teniendo en cuenta que:
E0 Sn2+/Sn= -0,14V, y el E0 Ni2+/Ni es -0,25V
los procesos que van a tener lugar, según indican las flechas ocasio-narán al cabo de cierto tiempo un estado de las planchas metálicas dado por el montaje:
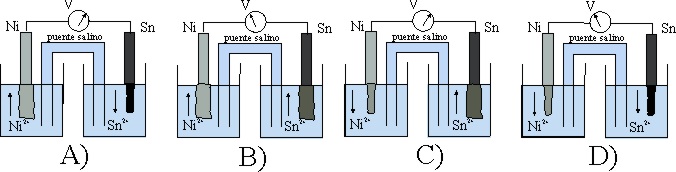
de todos los dados el correcto será el :
a) A
b) B
c) C
d) D

54*. En la foto se trata del montaje de una pila con electrodos de plomo y cinc, sumergidos en respectivas disoluciones de sus sulfatos. Teniendo en cuenta los respectivos potenciales normales E0 Pb2+/Pb = -0,13V y E0 Zn2+/Zn=-0,76V y observando lo que marca el voltímetro, podrás asegurar que:
a)El voltímetro está mal conectado
b)El resultado sería correcto si el cable azul se conectara al borne rojo
c)El ánodo de la pila tendría que ser el electrodo del plomo
d)La reacción que produciría la corriente eléctrica sería:
ZnSO4 + Pb -> PbSO4 + Zn
| V |
|
| F2 +2e→2F- |
2,87
|
| PbO2+2e→Pb2+ |
1,68
|
| MnO4-+5e→Mn2+ |
1,52
|
| Cl2+2e→2Cl-
|
1,36
|
| Cr2O7
2+6e→2Cr3+ |
1,33
|
| O2+4e→2H2O
|
1,23
|
| Br2+2e→2Br-
|
1,06
|
| NO3-+3e→NO
|
0,96
|
| Ag+
+e →Ag |
0,80
|
| I2+2e →2I-
|
0,53
|
| Cu2++2e →Cu |
0,34
|
| 2H+ +2e →H2 |
0,00
|
| Pb2++2e
→Pb |
-0,13
|
| Sn2++2e
→Sn |
-0,14
|
| Ni2++2e
→Ni |
-0,24
|
| PbSO4+2e→Pb Fe2++2e
→Fe |
-0,36
-0,44 |
| Zn2++2e
→Zn |
-0,76
|
| Mn2++2e
→Mn |
-1,19
|
| Al3++3e
→Al |
-1,66
|
| Mg2++2e→Mg
|
-2,37
|
| Na++e→Na
|
-2,71
|
| K++e→K
|
-2,92
|
| Li++e→Li
|
-3,05
|

55. La pila de la foto está formada por una lámina de cinc, inmersa en una disolución de sulfato de cinc, y una sortija de un material desconocido de color blanco grisáceo. Teniendo en cuenta la tabla de potenciales normales, la disposición de las conexiones así como lo que marca el voltímetro (siempre un poco menos que el valor teórico), dirás que el material de la sortija será:
a) Cromo
b) Níquel
c) Plata
d) Aluminio

56.La fotografía dada corresponde a una pila formada por la sortija anterior, conectada a una moneda de un material desconocido, e inmersas en sus disoluciones respectivas. Según lo que marca el voltímetro y teniendo en cuenta la tabla de potenciales normales de reducción dados en el test anterior, dirás el material fundamental de la moneda es:
a) Cobre
b) Níquel
c) Plata
d) Aluminio

Foto 1

Foto 2
57*. En la foto 1, se sumerge un tornillo de hierro en una disolución de nitrato de plata, obteniéndose el resultado que se aprecia en la foto 2. Teniendo en cuenta los potenciales normales de reducción dados (en test anterior), podrás decir que:
a) El hierro se oxidó
b) La plata se oxidó
c) Se forma un precipitado de plata
d) La plata se redujo

58. En la fotografía anterior, se observa una pila formada por una sortija de plata, y una moneda de una aleación que contiene un porcentaje de plata, según lo visto anteriormente podrás asegurar que el voltímetro de la pila marcará:
a) 0
b) un voltaje negativo próximo a 0
c) un voltaje positivo próximo a cero
d) no marcaría nada

Foto 1

Foto 2
59. La foto 1 corresponde a un tornillo de hierro A que se sumerge en una disolución de sulfato de cobre(II) B. Al cabo de cierto tiempo se toma la foto 2. Del conocimiento de los potenciales normales de reducción podrás asegurar que:
a) B’ es una disolución de sulfato de hierro(II)
b) B’ es una disolución de sulfato de cobre(II), con menor concentración
de la inicial y algo de sulfato de hierro(II)
c) A’ es el tornillo cubierto de un ligero polvo de cobre en la parte
sumergida
d) La reacción redox que se realizó espontá-neamente sería: CuSO4 + Fe -> FeSO4 + Cu

60*. Observa la diferencia de colores de las disoluciones de sulfato de cobre(II), en A, y la B, obtenida cuando en la primera se sumerge un clavo de hierro. Ello es debido a que:
a) El Cu(II) se transformó en Fe(II)
b) B es una mezcla de disoluciones con iones Cu(II) y Fe(II)
c) El hierro se oxidó
d)El hierro se ha disuelto en el sulfato de cobre(II)