
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Redox 6
101*. Mucha gente ha sido envenenada a lo largo
de los siglos, al tomar bebidas alcohólicas adulteradas, al sustituir el etanol
o alcohol vínico por el metílico o alcohol de madera, que ataca el nervio
óptico pero es mucho mas barato. El precio del metílico es tan barato porque
se puede conseguir industrialmente por síntesis directa entre el monóxido
de carbono y el hidrógeno. Esta reacción es un proceso redox del cual, si
lo ajustas dirás que:
a) El número de oxidación
del carbono en el metanol es 2-
b) El monóxido de carbono
actuó como reductor
c) El oxidante gana 4
mol de electrones por mol
d)El proceso necesita
de presión externa para producirse
102*. Cuando
tomas alguna bebida alcohólica deberás tener mucho cuidado si conduces después, pues te pueden
hacer la prueba del aliento, que no es mas que un redox en la que el dicromato
potásico de color amarillo, oxida al etanol, hasta etanoico, pasando a cromo(III)
de color verdoso. La intensidad del cambio de color indicará tu porcentaje
de alcohol. Si ajustas la reacción dirás que:
a) El metanol pierde
4 moles de electrones por mol
b) El dicromato potásico
actúa en la reacción de oxidación
c) 1g de etanol necesita
como mínimo para su reacción, 3 de dicromato potásico
d) En la reacción se
transfieren 6 electrones por mol de dicromato
MASAS MOLARES:
dicromato potásico= 294g.mol-1 etanol=46 g.mol-1
103*. En nuestras casas, de forma cotidiana, estamos
reproduciendo una reacción redox característica: la combustión del gas natural
(fundamentalmente, 9 moles de metano, por cada uno de etano), con oxígeno,
para producir dióxido de carbono y agua. Si ajustas esta reacción redox, manteniendo
el porcentaje de la mezcla en la combustión, dirás que:
a)Por cada 10 moles de
mezcla gaseosa, harían falta 21,5 moles de oxígeno
b)El número de moles
de electrones perdidos por los diez moles será de 86
c)9 moles de metano deberán
ganar 72 moles de electrones
d) El etano pierde 14
moles de electrones por mol que reaccione
104. La gasolina es una mezcla de isooctano y heptano, según el porcentaje que se indica en cada surtidor. Si la consideramos como octano, su combustión es un proceso redox violento, en el cual:
a) El octano actúa como reductor en el proceso
b) El carbono en el octano actúa con números de oxidación 1- y 3-
c) Un mol de octano pierde 25 moles de electrones
d) Un litro de octano de densidad 0,9kg/L, necesita de 1500litros de oxígeno
en condiciones normales para su combustión.
MASA MOLAR DEL OCTANO=114g.mol-1

105. Como puedes observar, la reacción entre el permanganato potásico con unas gotas de glicerina es muy violenta y requiere que se haga con protección, esto es debido a que se trata de una reacción redox, con producción de gases (dióxido de carbono y agua), aunque también se produzca un residuo sólido de óxido de manganeso(III), y carbonato potásico. De esta reacción ajustada por el método ion-electrón podrás decir que:
a) Un mol de glicerina pierde 14 electrones
b) El máximo cambio de número de oxidación es de 1- a 4+
c) Por cada mol de glicerina se producirían 22,4 L de gas en condiciones
normales
d) Por cada mol de glicerina se produce 4 de carbonato potásico
106*. Hace bastantes años, en los pueblos a los que no llegaba la luz eléctrica, se empleaba para iluminar las lámparas de gas. Para ello se usaba la combustión del etino, que se formaba a partir de carburo cálcico y agua. La combustión del gas acetileno o etino es como todas las combustiones, una reacción redox de la de podrías afirmar que:
a)El carbono del etino cambia su número de oxidación de 1+ a 4+
b) El etino actúa como reductor
perdiendo 10 moles de electrones por mol
c) 20 litros de etino necesitan para su combustión completa, 50 de oxígeno
d) En la reacción dada se produce una contracción de volumen
107*. La fotosíntesis es el proceso fundamental para la vida, y es una reacción redox que sólo se produce si se aporta mucha energía al sistema, en este caso energía solar, de origen nuclear. Como sistema redox, se puede considerar una simple reacción entre el dióxido de carbono y el agua, para producir oxígeno molecular, y el monómero de los hidratos de carbono H2CO. De este proceso podrías decir que:
a) El máximo cambio del número de oxidación es de 4+ a 0
b)El oxígeno del agua actúa como reductor
c)El carbono actúa como oxidante
d)Para formar una molécula de monómero sólo se requiere una de dióxido
de carbono y otra de agua
108.Cuando fríes, muchas veces notas un desagradable olor picante, que incluso te hace llorar. Esto es debido a la producción de acroleína. La acroleína (aceite que pica, origen de su nombre), no es más que el propenal, producido por la oxidación de la glicerina(propanotriol) de las grasas, catalizada por el hierro de la sartén. Esta reacción redox es peculiar ya que:
a) Los carbonos de la glicerina
se comportan de diferente manera
b) Se trata de un proceso redox interno
c) El oxígeno es el agente oxidante
d)El hidrógeno es el reductor
109.El enranciamiento de las mantequillas con su olor característico, se produce fundamentalmente en las grasas con insaturaciones (dobles enlaces), ya que se oxidan con el oxígeno del aire, rompiéndose el doble enlace y produciéndose aldehidos volátiles, responsables de dicho olor Si por cada doble enlace se producen 2 moléculas de aldehido, el números de electrones transferido por mol de eteno será:
a) 2 b) 4 c) 6
d) 8
110*. La nitroglicerina, sintetizada en 1846, por el químico italiano Ascanio Sobrero. Su primer uso, fue como vasodilatador sublingual, ya en 1847, remedio para la angina de pecho. Diecisiete años mas tarde Alfred Nobel, estabilizándolo con tierra de diatomeas, creó la dinamita, gracias a la cual se pudieron hacer las grandes obras de finales del XIX y principios del XX; los canales de Suez y de Panamá. En esta reacción la nitroglicerina C3H5(NO3)3, va a descomponerse en una serie de moléculas en estado gaseoso (de ahí la violencia de la explosión) como nitrógeno, dióxido de carbono, vapor de agua y oxígeno. De esta reacción explosiva simplemente por choque podrías decir, si la ajustas correctamente que
a) El agente oxidante
es el oxígeno
b) Se trata de un redox
interno
c)Los carbonos siempre
se reducen
d)Se producen cerca de
100L de gas
por mol de nitroglicerina
111. En 1898, el alemán Walter
Nernst, en su libro “Theoretische Chemie”, introduce una ecuación que será
fundamental para estudiar la variación de los potenciales de oxidación con
circunstancias como la concentración, la presión y la temperatura. La llamada
ecuación de Nernst, medía la diferencia de potencial entre el metal y el electrolito y venía dada
por
![]() , siendo P y p, las presiones de disolución y osmótica y n la valencia
metálica de los iones en disolución. Esta ecuación será modificada hasta la
actual
, siendo P y p, las presiones de disolución y osmótica y n la valencia
metálica de los iones en disolución. Esta ecuación será modificada hasta la
actual
![]() , siendo Q el cociente de la reacción que produce dicha diferencia de potencial.
Ello hace que si se parte de condiciones normales o estándar a lo largo del
desarrollo de la reacción redox, vayan variando. En el caso de la pila Daniell
, esta variación vendría dada por la gráfica:
, siendo Q el cociente de la reacción que produce dicha diferencia de potencial.
Ello hace que si se parte de condiciones normales o estándar a lo largo del
desarrollo de la reacción redox, vayan variando. En el caso de la pila Daniell
, esta variación vendría dada por la gráfica:
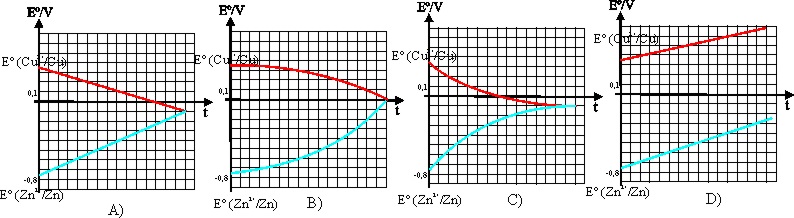
Siendo de todas las gráficas dadas la única correcta la :
a) A b) B c) C d) D
![]() y
y
![]() , el voltímetro en vez de marcar 1,1V, indicaría:
, el voltímetro en vez de marcar 1,1V, indicaría:
a) Más b) Menos
c) Igual d) No marcaría
| V |
|
| F2 +2e→2F- |
2,87
|
| PbO2+2e→Pb2+ |
1,68
|
| MnO4-+5e→Mn2+ |
1,52
|
| Cl2+2e→2Cl-
|
1,36
|
| Cr2O7
2+6e→2Cr3+ |
1,33
|
| O2+4e→2H2O
|
1,23
|
| Br2+2e→2Br-
|
1,06
|
| NO3-+3e→NO
|
0,96
|
| Ag+
+e →Ag |
0,80
|
| I2+2e →2I-
|
0,53
|
| Cu2++2e →Cu |
0,34
|
| 2H+ +2e →H2 |
0,00
|
| Pb2++2e
→Pb |
-0,13
|
| Sn2++2e
→Sn |
-0,14
|
| Ni2++2e
→Ni |
-0,24
|
| PbSO4+2e→Pb Fe2++2e
→Fe |
-0,36
-0,44 |
| Zn2++2e
→Zn |
-0,76
|
| Mn2++2e
→Mn |
-1,19
|
| Al3++3e
→Al |
-1,66
|
| Mg2++2e→Mg
|
-2,37
|
| Na++e→Na
|
-2,71
|
| K++e→K
|
-2,92
|
| Li++e→Li
|
-3,05
|
113. Si en la pila anterior echamos unos cristalitos de sulfato de cobre pentahidratado, el voltímetro marcaría ahora:
a) Más b) Menos
c) Igual d) No marcaría
114. Si en la pila Daniell, las concentraciones molares de los iones fueran
![]() y
y
![]() , el voltímetro indicaría:
, el voltímetro indicaría:
a) 1,20V b 1,15V) c) 1,10V d) 1,17V
115. También varía el potencial normal de reducción con el pH, lo cual deriva de la propia ecuación de Nernst. Así, si tuviéramos el electrodo de hidrógeno a una presión de 1 atmósfera, pero a un pH=3, y dada la tabla de potenciales normales, diremos que el del hidrógeno será en voltios:
a) 0 b) -0,18
c) 0,18
d) -0,41
116. El potencial del electrodo de hidrógeno en agua pura y a una
presión de 0,9 atmósferas será en voltios:
a) 0,53 b) -0,53 c) 0,42 d) -0,42
117. Como puedes ver en la tabla anterior el permanganato potásico puede oxidar al cloruro sódico para obtener cloro en condiciones normales, pero si la concentración del mismo fuera similar a la de la sal manganosa y el pH=4, veríamos que :
a) Lo oxidaría más rápidamente
b) Lo reduciría
c) El potencial de reducción sería
de 1V d) Lo oxidaría de igual forma
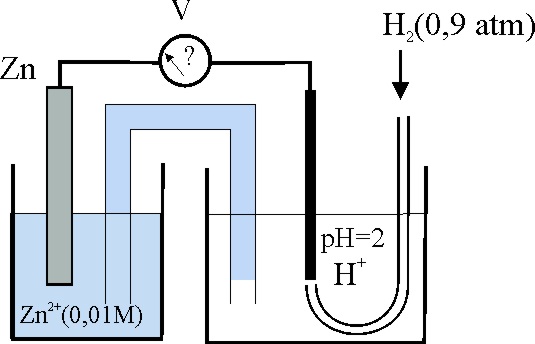
118.En condiciones estándar el voltímetro de este montaje marcaría -0,74V. En las condiciones que se dan, tendría que marcar, en voltios:
a)-0,74 b)-0,72
c)-0,78 d)-0,80
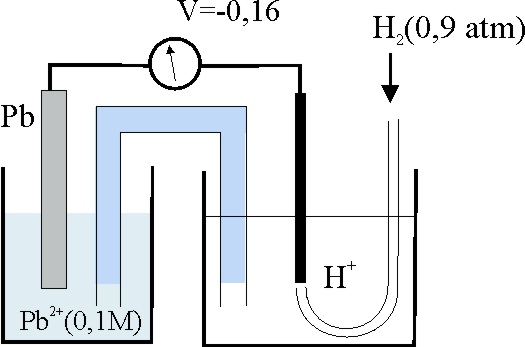
119.En condiciones estándar el voltímetro de este montaje marcaría -0,13V. Para que marque lo indicado, el pH de la disolución ácida deberá ser aproximadamente:
a)1 b)2 c)3 d)4
![]() , sabiendo que la diferencia de potencial estándar es de 1,36V,
un voltímetro situado entre hemiceldas en estas condiciones, marcaría:
, sabiendo que la diferencia de potencial estándar es de 1,36V,
un voltímetro situado entre hemiceldas en estas condiciones, marcaría:
a) 1,4V b)1,19V c)1,31V d)1,51V