ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA


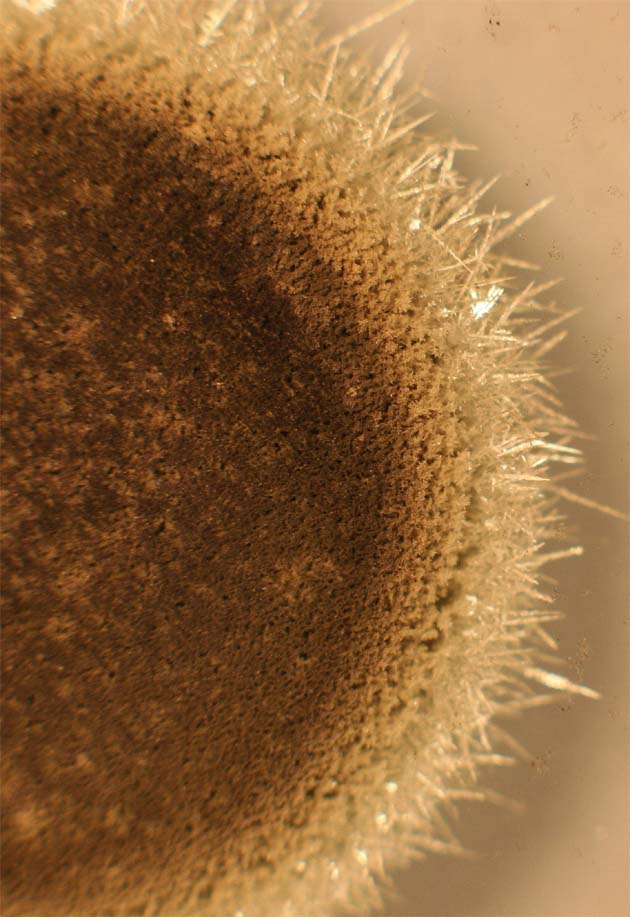
Foto 2
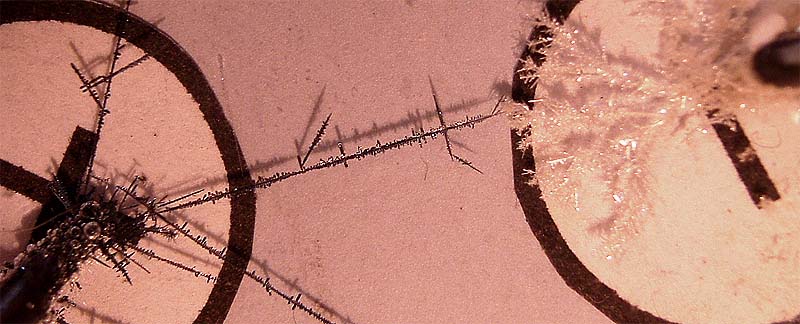
181. Si se dispone una moneda de cobre, sobre una disolución de nitrato de plata (foto 1), los resultados se aprecian en la foto 2. Se ha obtenido lo que fue llamado un “árbol de Diana”. En este proceso redox:
a) El cobre oxida a la plata
b) El
oxígeno oxida al cobre
c) La plata se reduce
d) El nitrato de plata actúa como oxidante
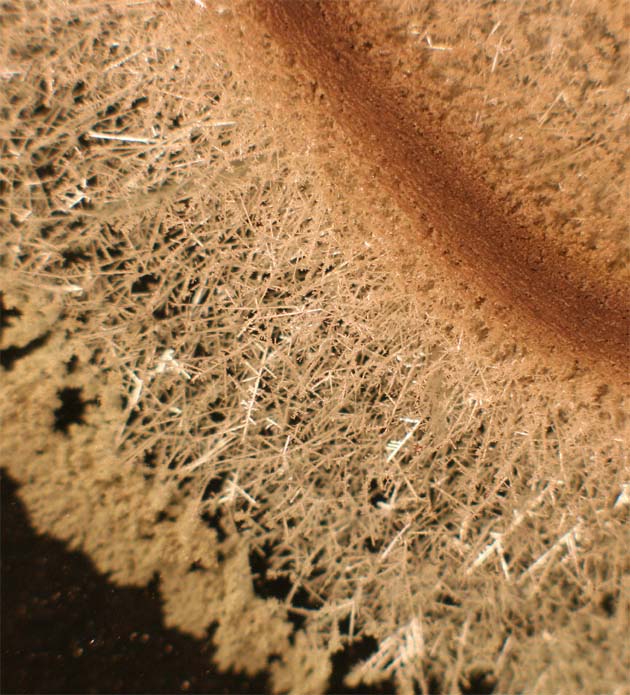
Fig.2
Fig.1
182. La formación de un árbol de Diana por precipitación de la plata de una disolución de nitrato de plata sobre el cobre de un alambre (fig. 1), al cabo de un determinado tiempo (fig. 2), se complica al producirse agujas castaño rojizas, ello se debe a:
a)La plata se oxida con el oxígeno del aire
b)El cobre se oxida con el oxígeno del aire
c)Se forma un árbol de cobre
d) Se forma un
precipitado de óxido de plata
191. Si se dispone en una cubeta electrolítica, una disolución de nitrato de plata, y si se depositan en el cátodo 23,8 g de plata, en 2 horas, dirás que:
a) Los electrones que necesarios para producirlo fueron1023
b) En el ánodo se desprende hidrógeno
c) El volumen de oxígeno a 700mmHg de presión y 20ºC, desprendido fue
de 1,4L
d) La intensidad de la corriente que tuvo que circular fue de casi 3A
DATOS: MASAS ATÓMICAS: Ag=107,8. F=96500C. R=0,082atm.L/K.mol. NAvog=6,22.1023e/mol
192. Se disponen 2 L de una disolución 1M de cloruro potásico, en una cubeta electrolítica, por la que circulan 5 amperios. Pasa 1 hora, y de los productos obtenidos podrás informar que:
a) En el cátodo se deposita potasio
b) El volumen de los gases obtenidos en condiciones normales es 4L
c) La concentración final del cloruro potásico fue 0,5M
d) El pH habrá aumentado en 6 unidades
DATOS: F=96500C. R=0,082atm.L/K.mol.
MASAS ATÓMICAS: Cl=35,5 ; K=39, O=16, H=1
193*. Se disponen de 74,5g de cloruro potásico,
y se disuelven hasta obtener dos litros de disolución, que llena una cuba electrolítica. Se hace pasar una corriente
de 10 A hasta descarga total.
a) El tiempo necesario
para ello fue de aproximadamente 5000s
b) En la cubeta al
final quedará una disolución de
hidróxido potásico
c) El volumen de cloro
desprendido en condiciones normales son 4L
d) El pH final será 13,8 .
DATOS: F=96500C. V molar=22,4 L/mol. Cl=35,5 ; K=39,
O=16, H=1
194.Se hace circular corriente eléctrica a través de un cátodo en el que el permanganato se reduce a manganeso 2+.Si después de circular durante 603s, una corriente de 0,6 A, se redujo todo el permanganato contenido en 15 ml. Dirás que la molaridad del permanganato potásico era :
a) 0,005 b)
0,025 c) 0,05 d) 0,25
195*. La aspirina Bayer y la pila Leclanché llevan usándose casi 150 años, sin hubieran sufrido apenas modificaciones a través de ese tiempo. En el caso de esta última su éxito fue debido a que era la primera pila seca, esto es, no existía una disolución que se filtrara o alterara durante el proceso de descarga. Para ello los líquidos electrolíticos se convertían en una pasta especial que permitía la movilidad de iones y el transporte de la carga eléctrica. En este caso el polo positivo de la pila o cátodo estaba constituido por una barra de carbono sumergida en una pasta de dióxido de manganeso, mientras que el negativo o ánodo lo formaba una carcasa de cinc en contacto con una pasta de cloruro de cinc, todo ello empleando cloruro amónico como transportador iónico. Explicadas sus partes dirás que en el proceso redox responsable de la producción de 1,5V:
a) El dióxido de manganeso gana electrones b) El cinc pierde electrones
c) En el ánodo ocurre una reducción d) En el cátodo tiene lugar una oxidación
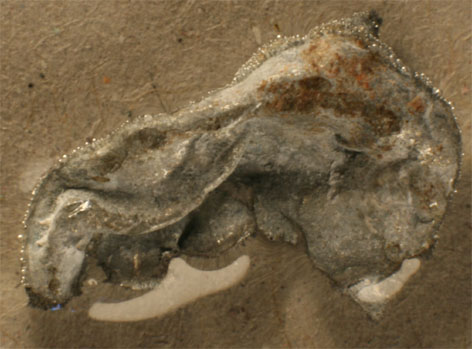
Foto 1
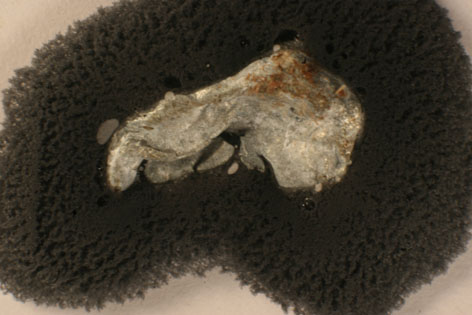
Foto 2
183. Si introducimos una pequeña lámina de cinc, en una disolución de nitrato de plomo(II) (foto.1). Al cabo de cierto tiempo, toma la apariencia de la foto 2, por formación sobre la lámina de un tupido bosque de plomo, denominado árbol de Saturno. En este proceso químico:
a) El Pb2+ oxida al Zn b)
El Pb oxida al Zn
c) El NO3- oxida al Zn d) El Zn2+ oxida al Pb
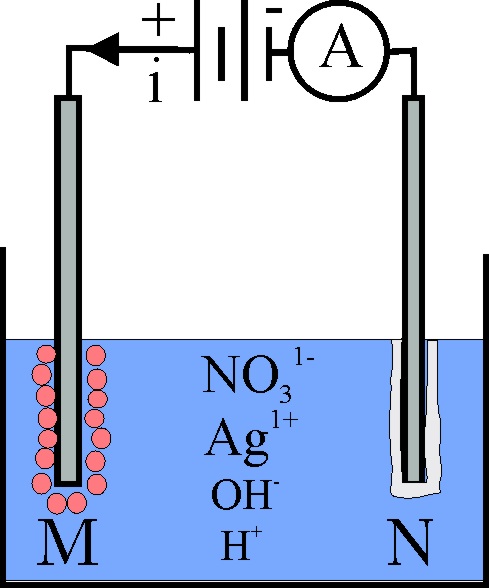
190*. Te dan una cuba electrolítica donde se introduce 2L de disolución 2M de nitrato de plata, tal como indica la figura. Al cabo de 10 horas se para la electrolisis, ya que toda la plata se ha depositado. Según eso sabrás que:
a) En M se desprende hidrógeno
b) En N se deposita la plata
c) La intensidad de la corriente era de 11A
d)El volumen de gas desprendido en condiciones normales fue de 22,4L
DATOS: F=96500C. Vmolar=22,4L/mol.

Foto 2
189. En la foto dada, se presenta el resultado de pasar una disolución de nitrato de plata, a través de dos electrodos, conectados a corriente continua. De ella podrás decir que:
a) En el electrodo positivo, se desprende oxígeno
b) En el electrodo negativo se produce una oxidación
c) En el electrodo negativo se desprende hidrógeno
d) En el electrodo negativo de produce un árbol de plata
197. Una batería de coche, dada en la figura, pesa bastante y tiene la peculiaridad que es recargable, o sea es una batería secundaria, ya que puede invertir el proceso de descarga con el movimiento del coche, aportando energía. Lo primero es lógico porque emplea electrodos de plomo y óxido de plomo(IV).Si los potenciales normales son Pb2+/Pb=-0,4 y PbO2/Pb2+=1,68V.)Dirás que:
a) La diferencia de potencial generada es aproximadamente de 2V
b) El polo positivo de la batería será el plomo
c) El oxidante será el ácido sulfúrico
d) El número de elementos en serie empleados para obtener una diferencia de potencial de 12 V, será de seis
198. En un acumulador de plomo, si los Eo Pb2+/Pb=-0,4V y PbO2/Pb2+=1,68V y la concentración del sulfato es 0,5M y el pH=1,2, la diferencia de potencial suministrada será, en voltios de:
a)2,1 b)1,96 c)1,90 d)2
199. En las batería de plomo, y en tiempo caluroso conviene agregar agua destilada a la disolución para reponer la evaporada y que el ácido sulfúrico esté siempre al 36% (densidad 1,286g/cm3). Si por echar demasiada agua destilada el ácido sulfúrico tuviera una densidad de 1,018g/cm3, de forma que contuviera 30,2g de sulfúrico por litro, en este caso la diferencia de potencial generada sería de:
a)
2,00 b) 1,90 c) 2,06 d)
1,98
DATOS: Eo Pb2+/Pb=-0,4V y PbO2/Pb2+=1,68V . Masa molar del ácido sulfúrico 98g.mol-1
200. En una batería de plomo el proceso de descarga, se debe a la acción del dióxido de plomo sobre el plomo, para generar sulfato de plomo(II) en medio ácido. Si los Eo Pb2+/Pb=-0,4V y PbO2/Pb2+=1,68V. Si el ácido sulfúrico empleado es del 33,4% (densidad=1,25g/cm3), pues presenta su mayor conductividad, el volumen del concentrado (d=1,84 g/cm3 y 96%), que deberás tomar para preparar 2 litros de disolución será aproximadamente de:
a)1000 mL b)470mL c) 50mL d)127mL
Si durante la descarga del acumulador, la concentración final del ácido es del 15,6% la masa de plomo que se gastó en la descarga será aproximadamente en g:
a)19 b)12 c)8 d)11
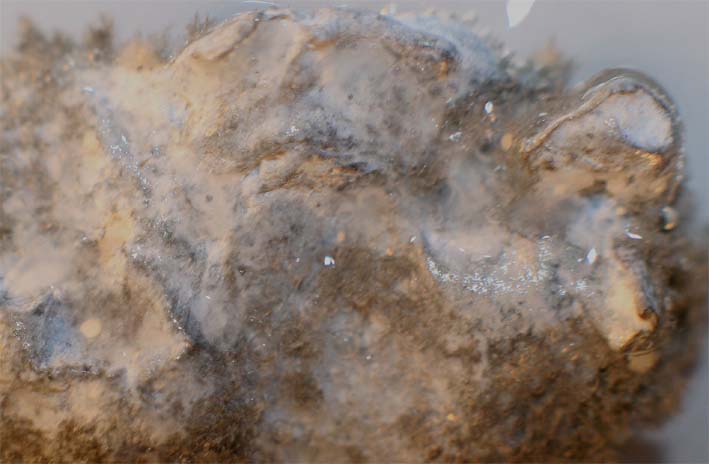
Foto 1
184. Desde la época caldea existió una asociación entre los planetas y los metales conocidos. Posteriormente, a partir del siglo VII, el estaño se relacionó con Júpiter, por eso su primer símbolo sería el que lo representaba, esto es el cetro y el trono de padre de los dioses romanos. Por eso la precipitación química en forma arborescente del metal estaño (fotos 1 y 2), se denominó por asimilación a lo que le ocurría a la plata, árbol de Júpiter. Este proceso se produce al introducir una lámina de cinc en una disolución de cloruro de estaño(II), a través del cual:
a) El Sn2+ oxida al Zn b)
El Sn oxida al Zn
c) El Cl- oxida al Zn d) El Zn2+ oxida al Sn
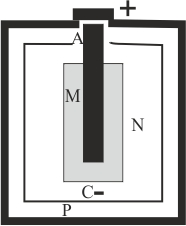
196. La pila Leclanché , generó los tipos de pilas secas y pilas alcalinas que se usan en la actualidad, las AAA, y la AA. Estas son pilas primarias o no recargables. En el esquema de la figura dirás que:
a) P corresponde al cátodo b)
N es la pasta catódica
c) M es la pasta anódica d) A es una barra de grafito
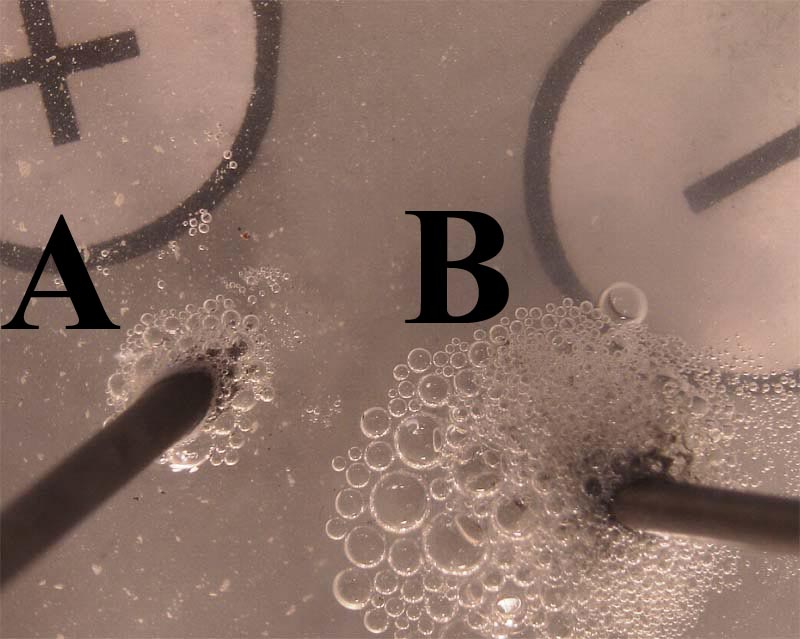
185*. En la foto dada, se presenta el resultado de pasar una disolución de cloruro de estaño(II), a través de dos electrodos, conectados a corriente continua. De ella podrás decir que:
a) En A, se desprende oxígeno
b) En A se produce una oxidación
c) En B se desprende hidrógeno
d) El volumen de gas que se desprende en B es mucho mayor que el que lo hace en A, lo cual no es posible
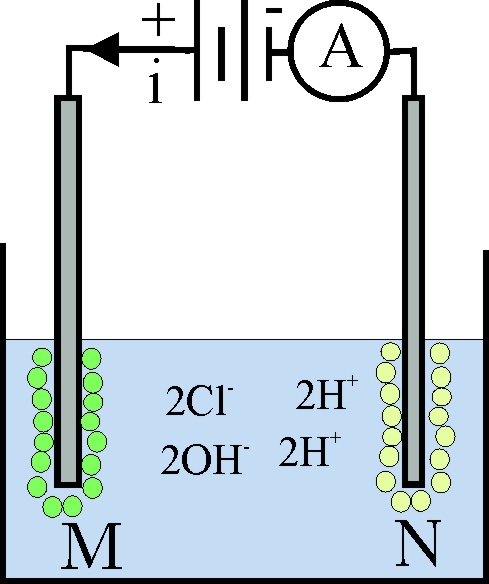
186*. En la cuba electrolítica de la figura se dispone 1 litro de una disolución 1M de ácido clorhídrico. A marca 4 amperios. Con los datos que te dan y en condiciones normales dirás que:
a) En N siempre se desprenderá hidrógeno
b) En M se desprende fundamentalmente cloro
c) El volumen teórico de gases desprendidos en dichas condiciones en 10
minutos es de 1litro
d) La concentración del ácido clorhídrico en disolución al cabo de ese
tiempo es 0,938M
DATOS: F=96500C. Vmolar=22,4L/mol.
187*. Se dispone de medio litro de ácido clorhídrico 1M, en una cuba electrolítica. Las condiciones externas son 0,91 atmósferas de presión y 20ºC. El proceso electrólitico dura aproximadamente 12 horas hasta total descomposición. En estas condiciones ocurren los siguientes fenómenos:
a) En el cátodo se desprenden 10L
de cloro b) La
intensidad de la corriente es de1A
c) El pH final de la disolución en la cubeta es de 7 d) A las 6 horas el pH era de 0,5
DATOS: MASAS ATOMICAS: Cl=35,5/H=1. F=96500C. R=0,082atm.L/K.mol.
188*. Se dispone de cierta cantidad de yoduro sódico y se disuelve hasta obtener dos litros de disolución, que llena una cuba electrolítica. Se hace pasar una corriente de 10A, durante media hora.
a) En el ánodo se
producirá yodo
b) En el cátodo se
desprenderá hidrógeno
c) El volumen de gas a 710mm de Hg y 15ºC
es de 2,4L
d) El pH final será
aproximadamente 13
F=96500C. R=0,082atm.L/K.mol.
