
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Test64-Orgánica 6
10.101*. El benceno actual, se conocería como bicarburato de hidrógeno (nomenclatura sistemática de
Lavoisier), cuando Faraday lo extrajo en 1825, de los
residuos del gas del alumbrado de Londres que se producía a su vez del aceite
de ballena. Sin embargo parece ser que ya en 1667 había sido obtenido por Glauber, junto con el fenol, en la destilación de carbón mineral, ya que
lo describe como un “oleum ardiente de color rojo que seca y cura poderosamente las úlceras húmedas”.
Su nombre de benzol y de ahí a benceno, sería propuesto por Hofmann,
20 años después. Pues bien, para este
compuesto de fórmula molecular C6H6, fueron propuestos
multitud de isómeros todos ellos con un ciclo exagonal,
sin embargo con carácter no cíclico fueron propuestas con anterioridad, por
Cooper. Los isómeros con dobles no cíclicos tendrán por nombre:
a) 1,2,3,4,5-hexapentaeno b) 1,2,3,4-hexateraeno c) 1,3,5-hexatrieno d)1,2,3,5-hexatetraeno
10.102*. Cuando Glauber hace la primera
referencia al benceno en 1649, en su “Furni novi philosophici”, en la destilación fraccionada del alquitrán del carbón, usando después spiritus salis fumans (HCl), para su
purificación, dice que se obtiene “un
agua ácida, que purificada no es inferior al óleo petri en el calor que produce, con un olor agradable y delicado”. Estaba
describiendo sin saberlo al benceno. Para este compuesto Mitscherlich(1833),
en Berlín propone el nombre de bencina.
Los isómero del mismo C6H6,
con cadena lineal y solo triples enlaces
y cadena lineal deberían llamarse:
a) 1,2-hexadiino b) 1,3-hexadiino c) 1,4-hexadiino d) 1,5-hexadiino

10.103*. Aunque no lo creas la primera expresión del benceno en forma
cerrada, fue empleado el círculo, que indicaba la indeterminación para predecir
su estructura y no el hexágono, como se ve en el modelo Lodschmidt,
de 1861. Sin embargo en este modelo no se justificaban:
a) Las propiedades físicas b) Sus propiedades químicas
c) Su fórmula molecular d) Su masa molecular

10.104*. El artículo donde presentó Kekulé la fórmula del benceno en modelo salchicha, que te
dan en el dibujo se titulaba “Sur les constitutions des substances aromatiques”.
Lo hizo en enero de 1865, en la Societé Chimique de París,
después de su disertación en dicha sociedad, sin embargo en este modelo:
a) No aparecía el ciclo hexagonal b) No se justificaba su fórmula molecular
c) No se sugerían la posibilidad de isómeros d) No se explicaban sus
propiedades químicas
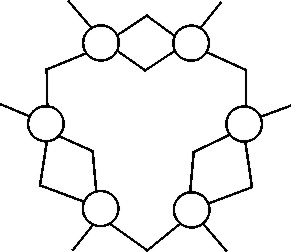
10.105. Aunque en muchos textos aparece el 1865 como
el año del anillo bencénico, (mismo Kekulé, mantenía
que lo había sido), lo que ocurre es que se presentó el 27 de enero de 1865, en
una sesión de la Sociedad Química de París, presidida por Pasteur, y presentado
por Wurtz, y se publicó en dos revistas, el Boletín
de dicha sociedad, en 1865 (en forma de fórmula salchicha) y en los Annalen de Liebig para Química y
Farmacia de 1866 (137, entre páginas 129 y 356) y en un libro (Lehrbuch) que comienza a publicar ese mismo año. Realmente Kekulé en los Annalen, solo
describe el benceno con un simple ciclo hexagonal no regular, tal como el
dibujo, sin embargo se siguien presentando modelos
lineales, e incluso ramificados con dobles y triples enlaces que correspondían
a dicha fórmula molecular. El número
posible de estos isómeros sería de:
a) 3 b) 4 c) 5 d) 6
10.106. Entre estos hechos, presenta el 11 de mayo de 1865, en la
Academia Real de Bélgica, al ser nombrado miembro de dicha sociedad, un trabajo
con el título “Notas sobre algunos productos del sustitución del benceno”, en que se establecen los isómeros sustituidos del
núcleo bencénico, y en su publicación en el Boletín de la Academia real belga,
también aparece el anillo hexagonal simple. Será en el 66 y mejor en el año
1872, cuando aparezca con los dobles enlaces, con una posible oscilación en las
posiciones de los mismos, estableciendo un equilibrio dinámico entre dos
formas, con lo cual ya no podían existir los dos isómeros orto, hecho que había
producido una controversia con Ladenburg. El número
de expresiones posibles para el benceno con un anillo hexagonal debería ser de:
a) 3 b) 4 c) 5 d)6
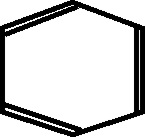
10.107. Ya se había demostrado que no todos los hidrógenos del anillo bencénico eran
iguales, y que existían isómeros de posición, que Körner,
otro discípulo de Kekulé, había llamado orto, meta y
para. Los prefijos orto y meta, procedentes del griego, ya eran empleados en la
nomenclatura de los ácidos. Aquí tienen el mismo sentido, orto, significa el
correcto, “el próximo”; meta, el otro, “el siguiente”. Para, indicaría el de
“al lado”, por eso el dimetilbenceno deberá tener un
número de isómeros con características aromáticas de:
a)2 b)3 c)4 d)5
10.108. En 1590, se descubre un compuesto que será
famosísimo en el mundo orgánico: Las flores de benjui (Blas de Vigenère,1590 ,"Traite du fer et du sel", publicado en 1618). Se extraía de un árbol
oriental el benjui, y al calentarlo sublimaba en agujas blancas (flores), del benjui,
que procede del árabe lubenyawi (incienso de Java),
derivarán benyawi, benjavi, benjui, benzui, benzina y
benzol, padres directos del benceno. Ese olor característico de la resina del
árbol, es lo que hará que la química del benceno se denominará aromática,
aunque modernamente su aromaticidad química sea algo bien distinto. Por muy bien que huela, no se debe hacer, pues elimina
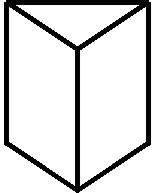
los glóbulos rojos de la sangre. El modelo que representaría la insaturación global del benceno sería el dado por Amstrong (se
adjunta), sin embargo en 1925, Robinson expresó esta deslocalización con:
a) Un anillo circular b)
Dobles enlaces acumulados
c) Una nuble pi d) Dobles enlaces alternados
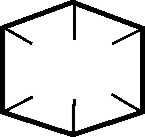
10.109*.Ladenburg, alumno de Kekulé, también desarrollará en 1869, un modelo espacial
prismático para el benceno. Este
modelo, respondía a los resultados termoquímicos que había obtenido Thomson, para el benceno, y no tenía el problema inicial
del modelo de Kekulé, con dos posibles isómeros orto.
No sería el único modelo espacial del benceno, ya que Rosenstiehl,
en 1869, había propuesto otro, formado por 6 tetraedros de carbono. Este modelo
del benceno pionero en la química espacial sería incorrecto porque :
a) No tendría isómeros para
b) No correspondería a la fórmula molecular
c) No justificaría la
deslocalización
d) No tendría isómeros orto
10.110. Un hidrocarburo contiene 92,3% de
C, siendo su densidad de vapor respecto al hidrógeno, de 39. El número de
isómeros no cíclicos del mismo y sin
características aromáticas. Será:
a) 7 b) 8 c)9 d)10
Masas atómicas C,12; H,1
10.111. Henri Sainte-Claire,
químico francés fue muy conocido por sus trabajos en la obtención del aluminio
a bajo precio (que llamó plata de arcilla), compitiendo con el norteamericano
Martin Hall, pero lo que no se conoce es que también extrajo y bautizó el
tolueno, del bálsamo de Tolú, resina de un árbol colombiano, en 1841. El
tolueno es el metilbenceno, que realmente no tiene isómeros aromáticos, al
contener un solo sustituyente sobre el núcleo bencénico, pero si los tiene de
cadena lineal. Si su fórmula es C6H5-CH3,
dirás que el número de isómeros de cadena lineal solo con dobles enlaces y
triples enlaces podrá ser de:
a) 3 b) 4 c) 5 d)
6
mientras que los isómeros con ramificaciones serán:
a) 3 b) 4 c) 5 d)
6
10.112. 4gramos
de un hidrocarburo aromático masa molar 92g/mol, producen por combustión 13,39
gramos de dióxido de carbono . Si su % de carbono es del 91,3%, el número de
isómeros cíclicos no aromáticos sería de
:
a) 4 b) 6 c) 8 d)
10
MASAS
ATÓMICAS: C,12; O,16; H;1
10.113. 4g. de un hidrocarburo aromático de masa molar
106g/mol, producen en su combustión, 13,28g de dióxido de carbono y 3,39g de
agua, con estos datos dirás que los isómeros
del mismo, con características bencénicas son:
a) 2 b) 3 c) 4 d)
5
Datos: Masas atómicas : C,12; O,16 ;H,1
10.114. El dimetil benceno,
llamado xileno, fue descubierto por Cahours en
1850,en el alquitrán obtenido de la destilación de la madera, y bautizado así
precisamente por eso (del griego xilos, madera), sin
embargo era una mezcla de isómeros, sólo separados por Fittig,
17 años después. El número de isómeros que éste separo con propiedades
bencénicas fue de:
a) 3 b) 4 c) 5 d)
6
10.115. El mesitileno, trimetil benceno, fue
aislado por primera vez por Robert Kane en 1838, pero
su fórmula no se determinó hasta 1848. Lo hizo Nicholson en el Royal College of Chemistry de Londres, dirigido por Hofmann. Su nombre procede del griego messiteros,
intermedio, y es debido a su estructura con los sustituyentes en posición
simétrica sobre el núcleo bencénico. Este compuesto tiene multitud de isómeros
aromáticos que podrías cifrar en: a)
3 b) 5 c) 6 d) 8
10.116. 10 gramos de un hidrocarburo aromático, con un
90% de carbono, ocupan a 500K y 700mm de presión un volumen de 3,71mL. Con
estos datos podrás decir que el número de isómeros con características
bencénicas del mismo es de:
a) 3 b) 5 c) 7 d)8
Masas atómicas: C,12; H, 1
10.117. El cumeno, hidrocarburo aromático con un núcleo bencénico y un
radical isopropilo, C6H5-C3H7 deriva su nombre de Procede de una especie muy conocida desde la antigüedad, el
comino, por que es el principio aromático de los
petróleos de donde se extrajo el hidrocarburo. El origen inmediato es el
francés cumin, que procede del árabe kammon, a través del español comino. Aquél lo hace del acaddio kamunu, y del sumerio gamun. Los
isómeros del mismo con propiedades aromáticas sería de:
a) 8 b) 5 c)
7 d)3
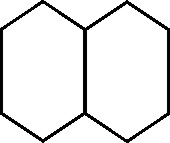
10.118.En 1866, Erlenmeyer sugirió que el naftaleno que había sido descubierto 47 años antes en el
alquitrán de hulla, estaba formado por dos anillos bencénicos unidos. El
naftaleno, C10H8, proviene de la nafta, que como se ha dicho
es egipcio con el significado de agua de fuego. Donde Na era agua y phtha fuego. Ese nombre revela una propiedad
característica, su combustión, por eso se empleaba en los templos del dios del
fuego (Ptha). También tiene isómeros de cadena lineal
lineales. El número de éstos formados únicamente con triples enlaces es de:
a) 3 b)4 c)5 d)6
10.120. Los espiro compuestos descubiertos y estudiado
por Baeyer, se denominan así porque son policiclos conectados a través de un carbono, con lo cual
tienen que girar sus planos para poder acomodarse en el espacio. El benceno C6H6,
tienen varios espiro isómeros que no tienen propiedades aromáticas, por conexión de dos ciclos de 3 y
4 carbonos. El número de isómeros de este tipo sería de:
a) 2 b) 4 c) 6 d)
8
mientras que con formato biciclo, serían:
a)2 b) 4 c) 6 d)
8
10.119. En el alquitrán de hulla, en 1832, Dumas y Laurent aíslan una
sustancia que denominaron antraceno, que por su origen llaman deriva del griego antrax (carbón). 37 años después, Grabe y Lieberman,
justifican su fórmula con una estructura de tres anillos bencénicos soldados,
todavía no se habían adaptado y generalizado las insaturaciones a los anillos, pero realmente sólo uno de los núcleos es aromático, pero
el número de isómeros con estas
características será de:
a) 2 b) 3 c) 4 d) 5